

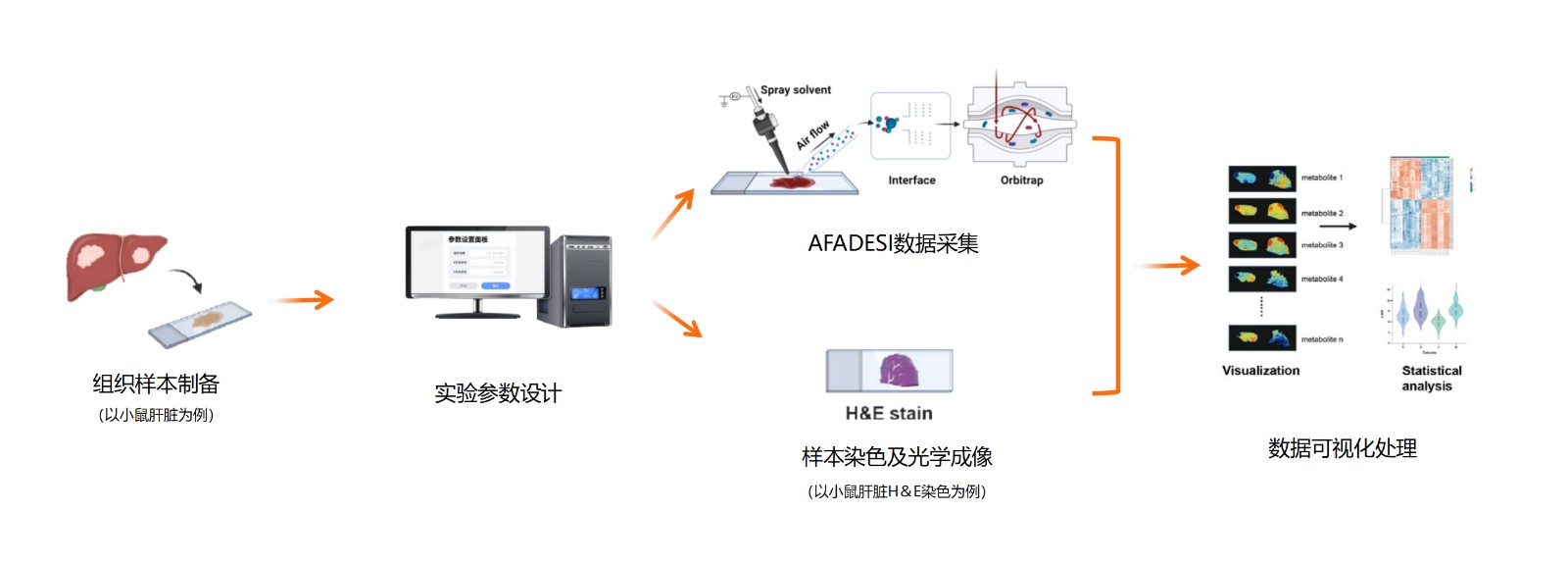
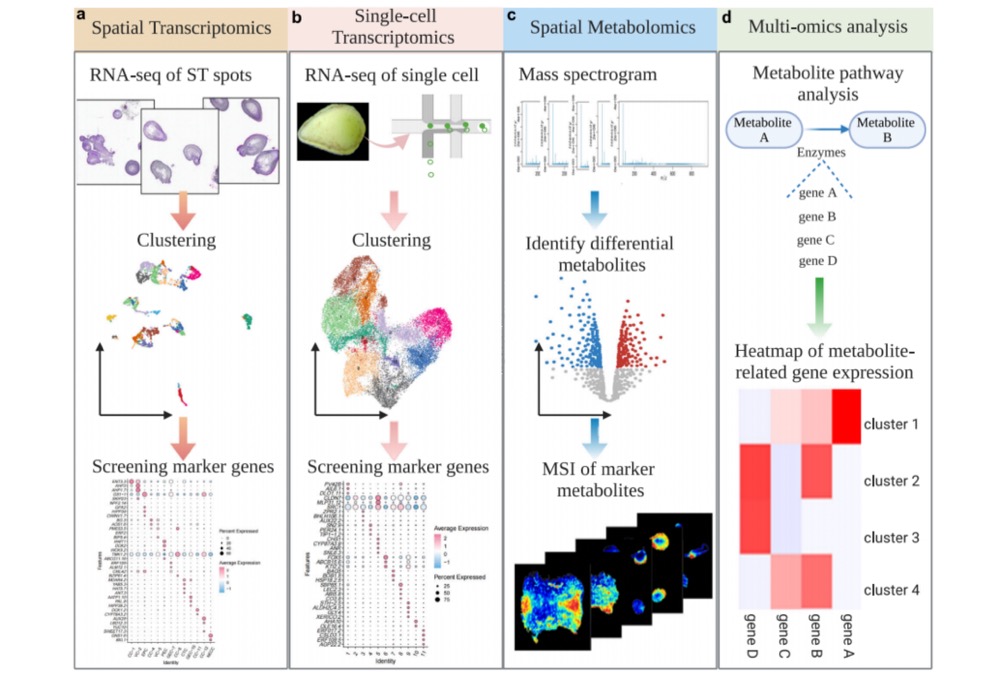
AFADESI-MSI 是一种新型常压敞开式离子化技术,不仅具备免标记原位分析优势,更创新性地引入空气动力学辅助离子传输,实现了离子的远距离高效传输,显著拓展了样品检测的空间范围与操作灵活性。该技术联用高分辨质谱仪,可达到皮克级检测灵敏度(动态范围横跨3个数量级),单次分析即可检测超过1500种代谢物特征峰,涵盖胆碱类、多胺类、氨基酸类、肉碱类、核苷类、核苷酸类、有机酸类、碳水化合物类、胆固醇类、胆酸类及脂质类等多种代谢物,为精准医学、环境毒理学、植物代谢学、法庭科学等领域研究提供有力支持。目前产品型号主要包括 AFAI-MSI 和 AFADESI-10。其中,AFADESI-10 配备大尺寸载物台并实现自动化升级,支持大样本高通量分析,可实现无人值守的自动连续扫描分析。

中国医学科学院药物研究所天然药物活性物质与功能国家重点实验室再帕尔·阿不力孜、贺玖明团队在《Nature Communications》上发表了一篇题为“Spatially resolved multi-omics highlights cell-specific metabolic remodeling and interactions in gastric cancer”的研究论文,采用自主研发的空气动力辅助解吸电喷雾离子化(AFADESI)技术,揭示了肿瘤内部生化异质性的特征,并结合多组学共定位分析,同步解析代谢物、脂质与基因表达的时空关联,揭示肿瘤-免疫界面(如精氨酸代谢重编程)关键驱动机制。为开发靶向肿瘤代谢微环境的精准治疗策略提供了全新视角。(文章链接:https://doi.org/10.1038/s41467-023-38360-5)
胃癌是全球高发恶性肿瘤(年新增病例超108万例),其恶性进展与肿瘤代谢重编程密切相关。癌细胞通过劫持代谢通路,在营养匮乏的微环境中摄取养分,以满足其异常增殖需求。近年研究发现,肿瘤细胞与微环境中免疫细胞、基质细胞间的代谢互作是驱动癌症进展和免疫逃逸的关键机制。尽管代谢组学与转录组学研究深化了对胃癌生物学的理解,但传统技术存在显著局限:组织均质化处理导致空间信息丢失,无法解析代谢物与基因在肿瘤核心区、侵袭前沿及免疫微环境中的原位分布;单细胞转录组(scRNA-seq)虽能刻画细胞异质性,却难以捕捉代谢物-脂质动态变化及其介导的细胞间代谢通讯。为突破这些瓶颈,本研究创新性地整合空间分辨代谢组学(SM)、脂质组学(SL)及转录组学(ST)技术,通过多组学空间共定位分析实现了三重突破——原位可视化胃癌微环境中代谢网络的细胞特异性分布;同步解析代谢物、脂质与基因表达的时空关联;揭示肿瘤-正常细胞界面的代谢重编程机制,为开发靶向代谢微环境的精准治疗策略提供了全新视角。
本研究采集7名胃癌患者的术后肿瘤组织,并构建人胃癌SGC7901细胞裸鼠异种移植模型(NPG品系)。经OCT包埋及冷冻切片后,分别进行三类组学分析:采用AFADESI-MSI平台获取组织原位代谢物分布空间信息,经MassImager Pro™软件完成背景扣除、图像重建及区域代谢物鉴定;通过MALDI-MSI技术捕获脂质分子空间特征,利用SCiLS Lab 2018b软件进行质谱图像处理;基于10x Genomics Visium平台(固定染色透化→空间条形码捕获→逆转录建库)生成全转录组空间图谱,并由Loupe Browser软件可视化基因表达。多组学数据经H&E染色图像对齐统一空间坐标系,整合MassImager Pro™、SCiLS Lab及Loupe Browser分析结果,构建代谢物-脂质-基因关联网络。最终通过免疫组化(CD20/CD38抗体)验证空间分布,并借助KOBAS-i和CellTypist工具完成通路注释与细胞分型,揭示肿瘤-正常细胞界面的代谢重编程机制。
精氨酸与脯氨酸在肿瘤代谢中发挥着关键作用,既往研究表明精氨酸可调控T细胞代谢与自噬影响肿瘤生长,与精氨酸代谢密切相关的脯氨酸已被证实参与肿瘤增殖侵袭。AFADESI-MSI在检测低分子量代谢物如氨基酸、多胺、有机酸等时具有高灵敏度和低背景干扰的显著优势。因此本研究通过AFADESI-MSI技术结合转录组学可视化精氨酸和脯氨酸的空间分布以及代谢通路中的关键代谢物和调控基因,研究发现,精氨酸和脯氨酸的合成关键前体谷氨酰胺和谷氨酸在肿瘤中分别呈现上调和下调的相反趋势。GLUL酶(催化谷氨酸→谷氨酰胺)在肿瘤、淋巴及黏膜肌层高表达(图1a3,b1);GLS酶(催化谷氨酰胺→谷氨酸)特异性高表达于肿瘤及淋巴组织(图1a4,b2)。精氨酸与脯氨酸在肿瘤、上皮及淋巴组织中显著积累(图1a7,a11),其合成调控基因ASS1、ALDH18A1、PYCR在相同区域亦上调(图1a5,a6,a10,b3-b5)。两者的代谢物多胺主要富集于肿瘤组织,其次分布于上皮、肠道化生及淋巴区(图1a14,a16,a18)。部分催化酶仅肿瘤表达上调(图1a9,a12,a17,b6,b8,b10),而ODC1、SRM在肿瘤及淋巴组织均高表达(图1a13,a15,b7,b9)。综上,胃癌中精氨酸/脯氨酸通路发生显著重编程,肿瘤组织内其合成代谢在代谢物及转录水平均增强。
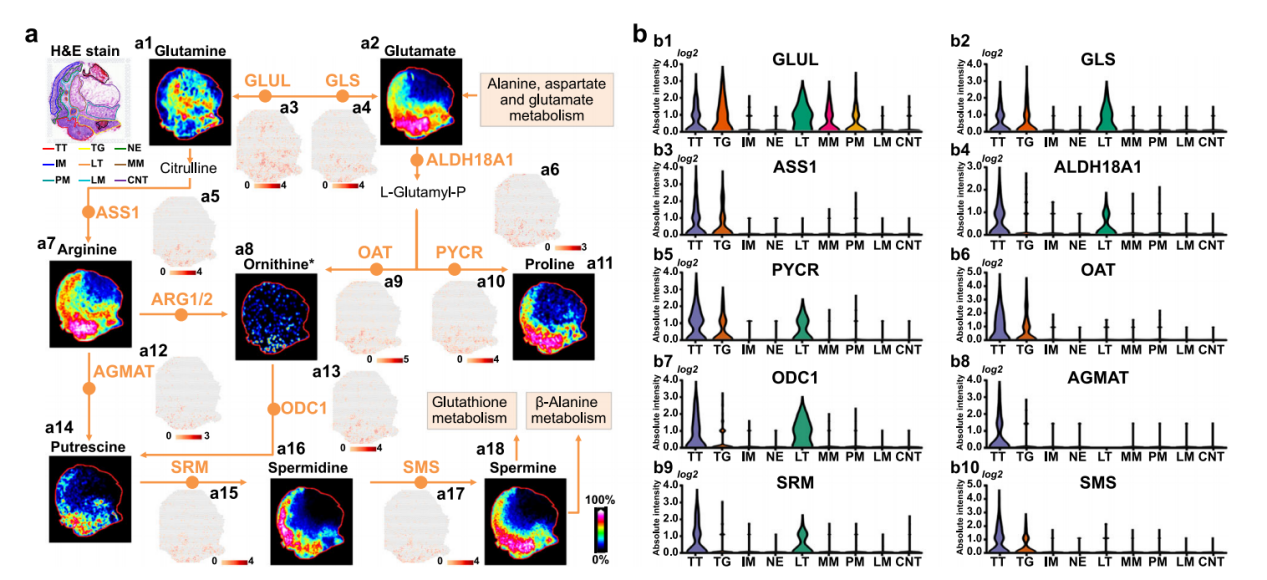
图1. 胃癌中精氨酸与脯氨酸代谢通路的重编程可视化。a精氨酸和脯氨酸代谢通路关键代谢物的质谱图像及基因空间表达图(质谱图像中的颜色强度为相对值,基因图像中的颜色强度为log2转换值)。b小提琴图展示精氨酸和脯氨酸代谢通路关键基因的表达水平。*鸟氨酸仅通过高分辨率质谱图鉴定。TT肿瘤组织,TG肿瘤及腺体组织,NE正常上皮,IM肠道化生,LT淋巴样组织,MM糕肌,PM肿瘤周围肌层,LM厚膜,CNT结缔组织。
脂质代谢重编程被认为是肿瘤细胞的特征。脂肪酸(FA)在细胞能量代谢和细胞信号传导中发挥着不可或缺的作用,磷脂是细胞膜的基本构成单元,同时可能参与肿瘤生长和转移相关的重要信号传导。本文针对这两种脂质的空间分布特征开展研究,结果显示,肿瘤区域通过FASN基因高表达驱动饱和脂肪酸FA-16:0富集(图4f1,g1),并激活SCD酶促进单不饱和磷脂(如PC-34:1、PE-36:1)生成(图4d5,d8,e2,e3);而淋巴组织则依赖FADS/ELOVL基因上调(图4f3,f4,g3,g4),积累多不饱和脂肪酸FA-20:4及相应磷脂PC-38:4/PE-38:4(图4d6,d9,e2,e3)。磷脂分布特征进一步揭示:饱和磷脂(PC-32:0/PE-34:0)在淋巴组织特异性富集(图4d4,d7,e2);多不饱和磷脂酰肌醇PI-34:1/PI-36:1集中于肿瘤上皮区(图4d10,d11,e4);而磷脂酰丝氨酸(PS)全域分布(图4d13-15,e5),磷脂酰甘油(PG)则偏好黏膜肌层/淋巴组织(图4d16-18,e6)。基因调控层面,肿瘤区高表达的CHKA/ETNK1基因(图4f5,f6,g5,g6)与分解酶PLD/LYPLA2(图4f7,f8,g7,g8)协同重塑脂质代谢流,证实肿瘤以单不饱和磷脂支持增殖、淋巴组织以多不饱和脂质参与免疫调节。
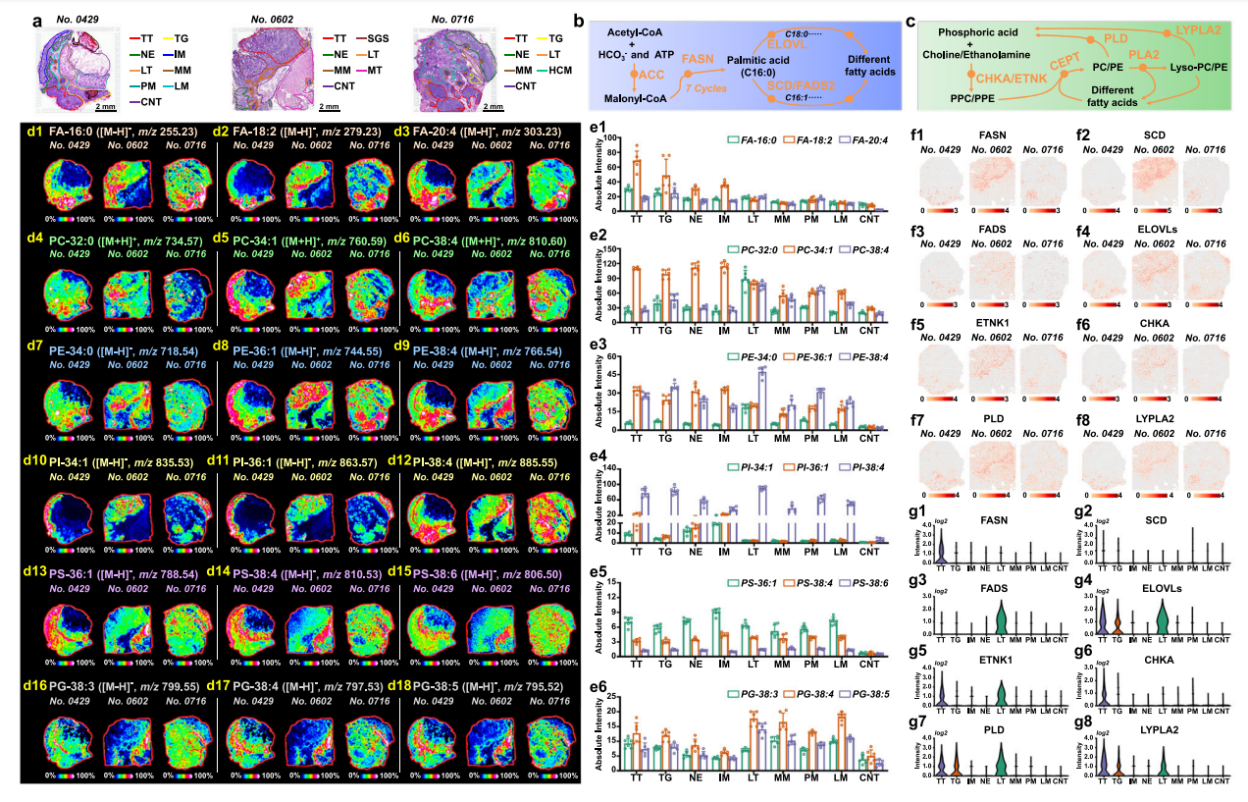
图2.胃癌中重编程脂质合成与代谢通路的可视化展示。a H&E染色胃癌组织切片图像,样本编号分别为“0429号”、“0602号”和“0716号”,比例尺=2毫米。实验重复三次。b脂肪酸从头合成通路。c磷脂酰胆碱与磷脂酰乙醇胺的合成代谢通路。 d胃癌组织代表性脂质的MS图像(颜色标尺中的强度值为相对值)。e患者“0429号”胃癌组织不同区域斑点中代表性脂质的表达水平(用于空间脂质组学分析的七个组织样本,来自患者“0429号”的n = 6个独立切片区域)。
在腺癌患者0602的病理渐变区域(正常上皮→锯齿状病变→肿瘤,图3a),空间代谢组学揭示分阶段代谢重编程:①能量代谢阶梯式激活:肿瘤区葡萄糖-磷酸盐显著富集(图3e),驱动无氧糖酵解(乳酸上调,图3f)及三羧酸循环异常(琥珀酸上调/苹果酸下调,图3g-h),伴随锯齿状病变中OXPHOS通路核心基因(NDUFS6/COX5A等)高表达(图3s);②免疫调节分子失衡:组胺在病变/肿瘤区渐进性耗竭(图3i-j),与AOC1基因(催化组胺氧化)的空间梯度上调完全吻合(图3t及免疫组化验证);③脂质重构特征:不饱和脂肪酸FA-18:1及溶血磷脂LysoPC-16:1差异化表达(图3k-l),受SCD基因渐进上调驱动(图3u);④硫酸酯类梯度积累:C22:0-OH-SFT等硫酸酯从正常上皮到肿瘤呈现浓度递增(图3m-q),标志微环境免疫信号持续重塑。空间多组学关联证实:锯齿状病变是代谢重编程的关键转折点,其OXPHOS激增与糖酵解前体积累为癌变提供能量基础。
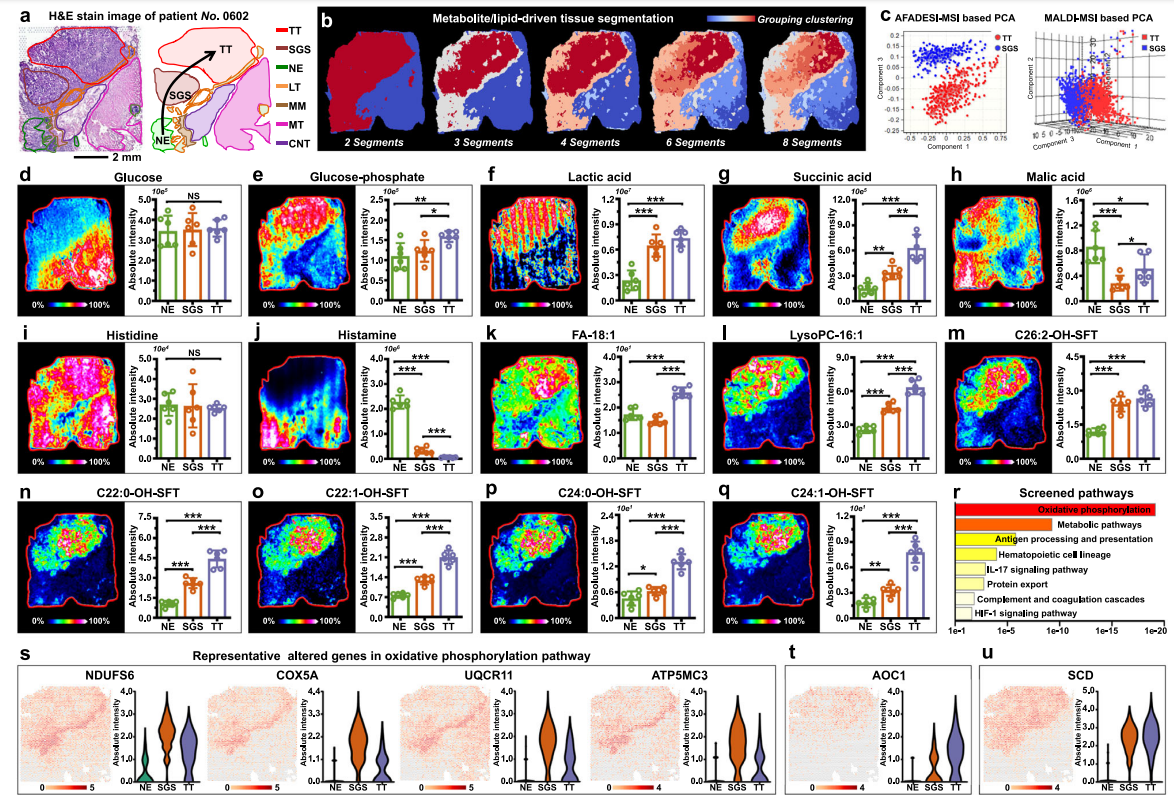
图3.胃癌分步代谢重编程可视化。a患者“0602号”胃癌组织切片的H&E染色图像,比例尺=2毫米。实验重复三次。b代谢物与脂质驱动的组织切片分割。c基于AFADESI-MSI和MALDI-MSI数据的肿瘤组织(TT)及锯齿状腺体结构(SGS)主成分分析(PCA)得分图谱。d-q MS图像及不同胃癌组织切片斑点中各化合物的含量,颜色标度表示相对强度。r SGS组织中富集的通路。s氧化磷酸化通路中代表性改变基因,图中t、u分别表示AOC1和SCD的空间表达图像,颜色标度为log2转换值。
空间转录组在胃癌肿瘤-邻近组织界面识别出关键过渡簇9(图4b),该区域在UMAP空间中位于正常簇(1/5/6/8/10)与肿瘤簇(2/3/4/7)之间(图4c)。功能注释表明簇9富集免疫炎症细胞(浆B细胞、滤泡B细胞及Th2样CD4+T细胞),该结果经过CD20/CD38免疫组化验证。代谢研究揭示其包含两种淋巴亚型:邻近肿瘤的瘤周淋巴组织(PLT)和远离肿瘤的远端淋巴组织(DLT)。PLT发生特异性代谢重塑:①谷氨酰胺耗竭(图4f,i),伴随谷氨酰胺转运体SLC1A5及GLS酶上调驱动谷氨酸积累(图4g,h,j,k,l);②脂肪酸代谢重编程:长链不饱和脂肪酸(花生四烯酸/二十二碳六烯酸等)显著富集(图4m-p),受合成基因FASN/SCD/ELOVL上调调控(图4q-s);③炎症介质生成:ALOX5AP上调促进花生四烯酸向白三烯转化(图4t),而二十二碳六烯酸则作为抗炎介质底物。此三重机制证实PLT通过剥夺谷氨酰胺和释放特定脂质介导免疫抑制,为肿瘤创造免疫豁免微环境。
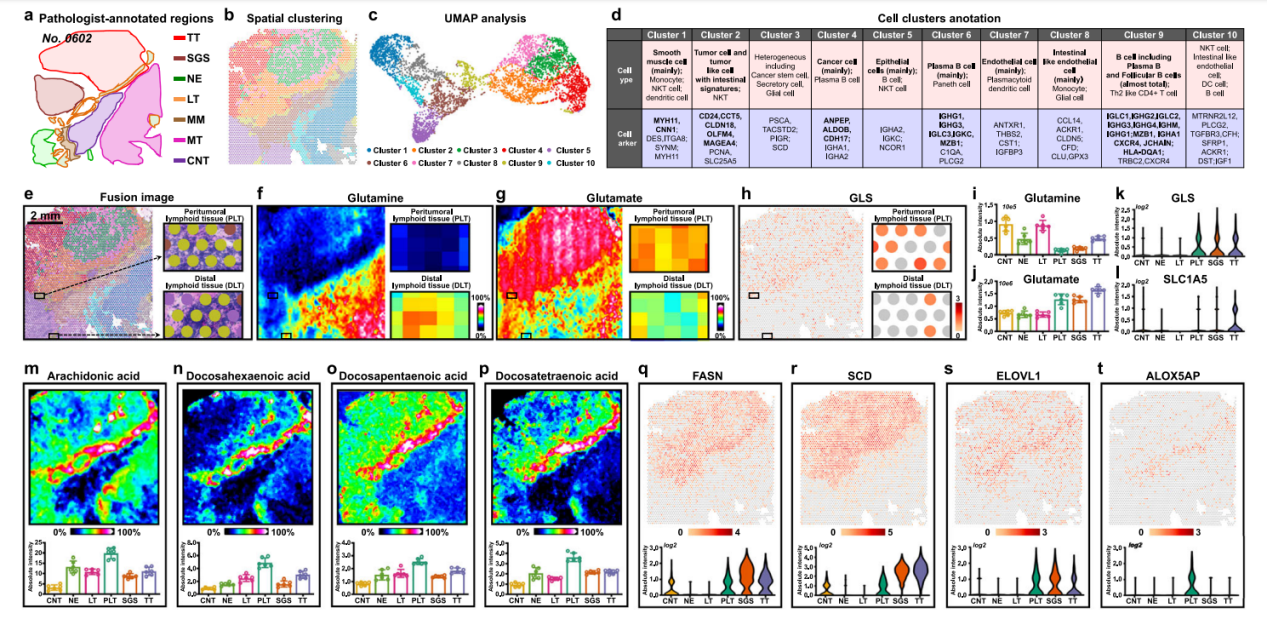
图4.胃癌肿瘤界面区域免疫代谢重编程的成像分析。a患者“0602号”癌症组织切片区域。b基于图谱聚类算法着色的Visium阵列点阵。c基于聚类着色的胃癌组织UMAP图谱。d胃癌组织细胞簇注释。e Visium阵列点阵与H&E染色图像融合对比,比例尺=2毫米。H&E染色实验重复三次。f、g整个胃癌组织切片及淋巴组织区域的谷氨酰胺与谷氨酸质谱图像,颜色标尺表示相对强度值。h整个胃癌组织切片及淋巴组织区域的GLS空间表达图谱,颜色标尺表示log2转换后的强度值。i-l不同胃癌组织切片中谷氨酰胺、谷氨酸、GLS基因及SLC1A5的表达水平。m-p MS图像及花生四烯酸、二十二碳六烯酸、二十二碳五烯酸和二十二碳六烯酸在胃癌组织切片中的表达水平,颜色标尺显示的是相对值。q-t空间图像及FASN、SCD、ELOVL1和ALOX5AP在胃癌组织中的表达水平,颜色标尺显示的是log2转换后的数值。
本研究展示了如何整合空间分辨代谢组学(SM)、脂质组学(SL)及转录组学(ST)来表征高度异质性癌症组织中复杂的肿瘤代谢重塑及其与肿瘤微环境的代谢相互作用,精准捕捉了肿瘤微环境中代谢物、脂质和基因表达特征及其空间变化,并将其与不同代谢通路建立关联。通过分析发现,癌症相关的代谢依赖性和免疫代谢改变不仅有助于深入理解肿瘤的分子机制,还揭示了潜在的治疗靶点,这些可作为癌症治疗的突破口。

数据来源:“质谱成像”微信公众号
中国医学科学院药物研究所天然药物活性物质与功能国家重点实验室贺玖明研究员/国家转化医学中心(上海)印彤教授团队在《Acta Pharmaceutica Sinica B》期刊上发表了一篇题为“Spatial metabolomics highlights metabolic reprogramming in acute myeloid leukemia mice through creatine pathway”的研究论文,采用自主研发的空气动力辅助解吸电喷雾离子化(AFADESI)技术,实现了AML小鼠肝转移灶内代谢物的高通量原位鉴定。揭示了AML肿瘤微环境中代谢重编程与相互作用机制,并进一步筛选出具有抑制AML增殖和浸润潜力的潜在药物。(文章链接:https://doi.org/10.1016/j.apsb.2024.07.004)
急性髓系白血病(AML)作为成人急性白血病首位,中位确诊年龄高达68岁,60岁以上患者五年生存率不足10%,其临床治疗面临严峻挑战。尸检显示40%-75% AML病例存在肝浸润,表明AML肝转移的核心微环境对疾病进展具有关键作用,但其中代谢调控机制长期未知。深入研究发现,AML细胞具有独特的能量代谢致命弱点——高度依赖氧化磷酸化(OXPHOS)而非糖酵解供能,这种代谢固执性构成其核心治疗靶点。其代谢适应机制表现为合成/能量/表观遗传多维调控的氨基酸网络重构,且OXPHOS依赖性独立于遗传异常,使AML对OXPHOS抑制剂高度敏感。本研究采用成熟的气流辅助解吸电喷雾电离质谱成像技术 (AFADESI-MSI),重点分析AML小鼠的肝转移情况。通过该技术可深入解析AML肿瘤微环境中代谢重编程与相互作用机制,并进一步筛选具有抑制AML增殖和浸润潜力的潜在药物。
本研究采用C57BL/6J小鼠构建急性髓系白血病(AML)肝转移模型,制备肝脏组织冷冻切片,进行苏木精-伊红(H&E)染色。采用AFADESI-MSI技术进行空间代谢组学分析,经LC-MS/MS鉴定肝组织代谢物,通过4D-DIA技术对肝组织/细胞裂解液进行蛋白质组学分析,用Spectronaut软件处理数据,采用免疫组化定位关键蛋白分布。另采集6例急性髓系白血病(AML)患者和10例非白血病患者进行代谢与转录组验证,并对肌酸转运蛋白(Slc6a8)抑制剂ompenaclid在细胞及动物水平进行功能实验,所有数据经GraphPad Prism 10统计分析。
研究通过AFADESI-MSI分析AML小鼠肝转移切片,揭示肿瘤区域与周围组织存在显著代谢差异。肿瘤病灶(TF)组与肿瘤周边组织(PR)组间筛选并鉴定出100种差异代谢物,其分布模式呈组间分化,通过这些差异进行代谢通路富集分析,结果显示精氨酸生物合成、精氨酸及脯氨酸代谢等代谢途径呈现富集现象(图1B和C)。主成分分析证实TF与PR组代谢物聚类分离(图1D),超类别归类表明差异代谢物以脂质及类脂分子(32.29%)和有机酸及其衍生物(27.08%)为主,凸显肿瘤微环境代谢复杂性。
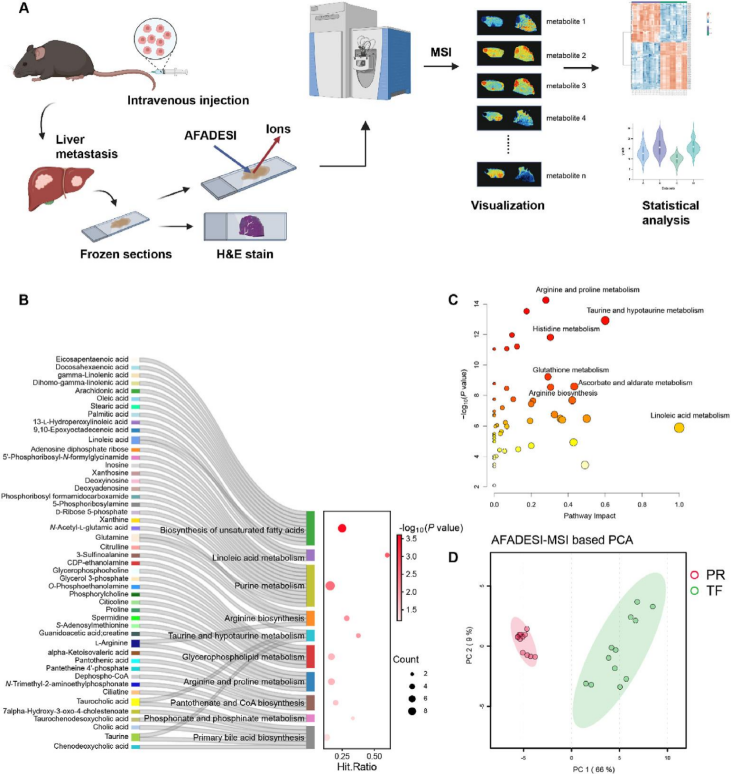
图1 使用AFADESI-MSI技术对白血病小鼠体内内源性代谢物进行空间代谢组学分析。(A)空间代谢组学方法与工作流程,旨在通过分子组织学特征鉴定代谢物。(B,C)对AFADESI-MSI数据进行富集分析(B)和通路分析(C),并使用MetaboAnalyst 6.0软件结合KEGG数据库对VIP值>1且P<0.05的显著差异表达代谢物进行分析,以揭示潜在生物通路及相互作用。(D)基于AFADESI-MSI数据的主成分分析(PCA)得分图,对比肿瘤周围区域(PR)与肿瘤病灶(TF)的代谢特征。PR指肿瘤周围区域,TF指肿瘤病灶
为验证质谱成像结果,本研究采用非靶向代谢组学技术分析了转录因子、蛋白酶体及肝细胞相关代谢物。分析结果显示,三组样本间存在33种差异表达显著的代谢物。基于MSI与非靶向代谢组学数据的整合分析(图S2A),前10条核心富集通路包括精氨酸生物合成、精氨酸/脯氨酸代谢、甘油磷脂代谢及嘌呤代谢(图2B)。TOP20通路分析进一步证实了组氨酸代谢、半胱氨酸/甲硫氨酸代谢及精氨酸相关通路的功能重要性。在KEGG二级分类中,氨基酸代谢是两种分析体系中最显著富集的代谢类别。主成分分析(PCA)清晰显示了三组样本代谢表型的差异(图2C)。重叠代谢物的对比分析揭示了精氨酸与脯氨酸代谢途径的显著富集特征(图2D, E),其热力图数据进一步呈现了组间特异的聚集模式(图2F, G)。这些结果凸显了精氨酸和脯氨酸代谢通路在相关生物过程中的潜在核心作用。鉴于观察到的显著代谢变化,研究团队进一步分析了TF、PR和HC组的蛋白质表达(采用4D-DIA蛋白质组学技术),结果显示肝脏转移组织中蛋白质组发生深刻改变,与代谢组学的结果一致。这些结果突出了精氨酸和脯氨酸代谢的重大破坏,表明这一代谢途径可能在AML的肿瘤进展中起着至关重要的作用。
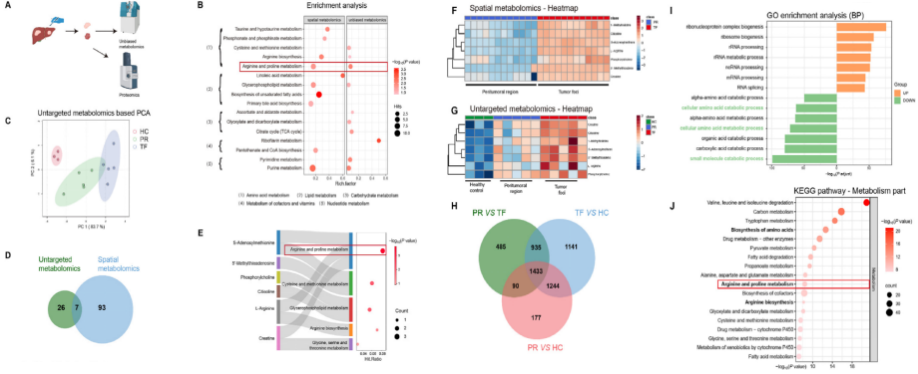
图2 肿瘤组织代谢重编程的多组学分析。(A)非靶向代谢组学与蛋白质组学工作流程示意图。(B)富集分析展示空间代谢组学与非靶向代谢组学中显著通路,附其KEGG通路二级分类总结。(C)基于非靶向代谢组学数据的主成分分析得分图,对比健康对照组(HC)、肿瘤转移组(TF)与转移组(PR)的代谢特征。(D)维恩图突出显示空间代谢组学与非靶向代谢组学间共同显著差异代谢物。(E)空间代谢组学与非靶向代谢组学重叠显著差异代谢物的富集分析。(F,G)热图展示空间代谢组学(F)与非靶向代谢组学(G)的重叠代谢物分布模式。(I)对上文列出的下调(倍数变化<0.7;P值<0.05)和上调(倍数变化>1.5;P值<0.05)的重叠蛋白进行基因本体论(GO)生物过程分析。(J)前20个富集的KEGG通路的汇总,重点聚焦代谢相关通路。PR:肿瘤周围区域;TF:肿瘤病灶;HC:健康对照组
本研究揭示急性髓系白血病(AML)小鼠肝转移瘤(TF)病灶区呈现精氨酸与脯氨酸代谢通路的显著重编程。质谱成像显示TF内L-精氨酸与瓜氨酸富集(图3B1, B6),但蛋白质组学分析发现精氨酸生物合成关键酶ASS1、ASL及传统代谢途径酶ARG1、OTC、Agmat表达均显著降低(图3C1-6)。代谢重塑表现为精氨酸代谢流向肌酸通路的关键转捩——肌酸合成中间体胍基乙酸减少而终产物肌酸升高(图3B2-3),且肌酸利用关键酶CKB在TF中表达上调(图3C9)。同时,多胺合成通过替代路径代偿性激活:亚精胺在TF内异常积累(图3B4),该过程由上调的SMS/SRM酶介导(图3C10-11),并伴随S-腺苷甲硫氨酸(SAM)空间分布增强(图3B5)。此外,脯氨酸代谢发生重构:谷氨酰胺水平下降(图3B7),GLUL(合成酶)表达下调而GLS(分解酶)表达上调(图3C12-13),驱动谷氨酰胺流向脯氨酸合成;最终通过ALDH18A1/PYCR酶表达升高(图3C15-18)导致L-脯氨酸在TF内特异性积累。该研究系统证实AML肝转移瘤通过精氨酸向肌酸通路的转捩、多胺合成的代偿性激活及脯氨酸代谢重构实现了代谢适应性生存。
为验证代谢重编程在急性髓系白血病(AML)发病机制中的作用。研究另采集了临床样本进行代谢组学和蛋白质组学验证,实验结果与小鼠模型高度一致。本研究从动物模型到原发性AML样本对AML的代谢重编程进行了全面验证,并强调了改变肌酸通路在AML病理生理学中的意义。
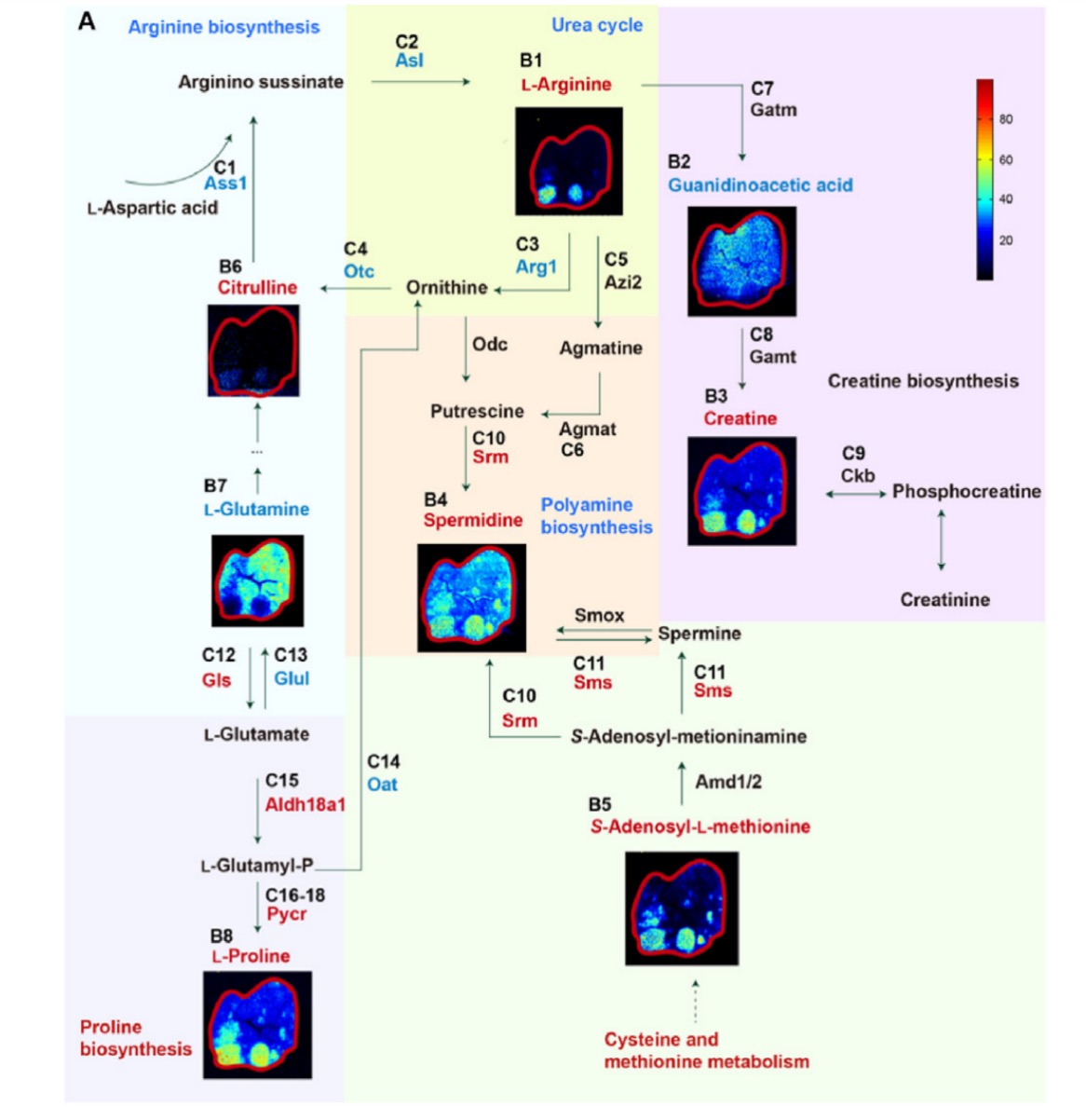
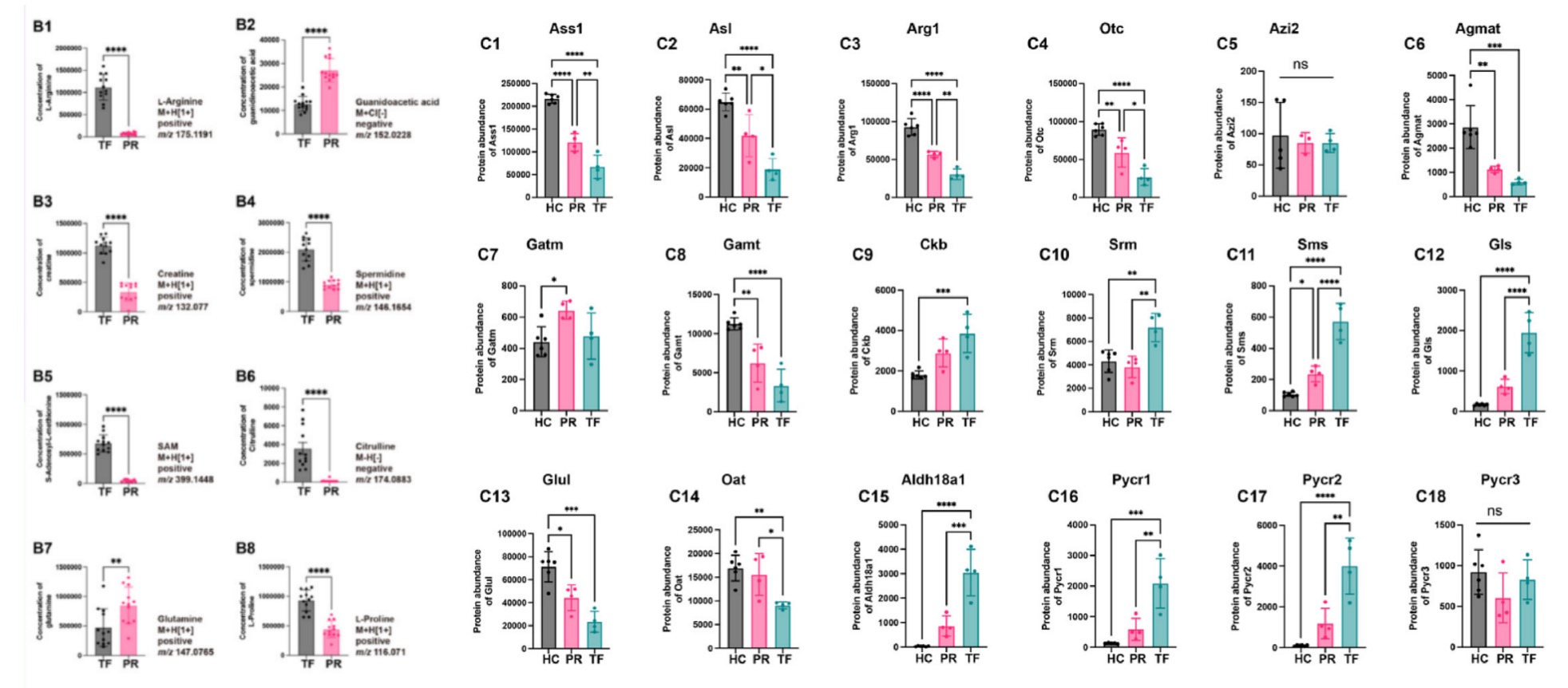
图3 AML小鼠肝转移灶中精氨酸与脯氨酸代谢重编程的可视化分析。A)空间代谢组学图像结合蛋白质组学数据,突显了精氨酸与脯氨酸代谢通路及其扩展代谢网络中的关键代谢物与酶类。(B)(B1-B8)柱状图详细展示了精氨酸与脯氨酸代谢通路中通过质谱检测到的代谢物丰度 水平。(C)(C1-C18)柱状图展示了精氨酸与脯氨酸代谢通路中关键酶类的蛋白质丰度。
肿瘤微环境中细胞互作依赖肌酸的局部生物合成与转运,据此推测急性髓系白血病(AML)细胞的肌酸蓄积存在双路径:①通过GATM/GAMT酶从精氨酸-甘氨酸合成;②经肌酸转运体Slc6a8外排(图4A)。ELISA检测证实AML小鼠血浆肌酸水平显著高于健康对照组(图5B),且肿瘤病灶(TF)组织内肌酸同步升高(图4C),此现象与既往报道的CKB致癌作用及本研究发现的CKB在TF中RNA/蛋白水平上调一致(图4D-E,G)。机制研究揭示:尽管肿瘤细胞内源性精氨酸合成抑制,但精氨酸转运体SLC7A1在TF中表达上调,保障了精氨酸供给;同时肌酸合成底物甘氨酸的转运体Slc6a9亦呈现上升趋势。关键合成酶GATM/GAMT在TF的蛋白水平均升高,其中GATM的RNA表达显著增加(图4F,H);而肌酸转运体Slc6a8在RNA及蛋白层面均持续上调(图4F,I)。上述结果综合表明,AML细胞通过协同激活肌酸双路径(合成酶上调+转运体增强) 重塑能量代谢网络,为靶向干预提供新方向。
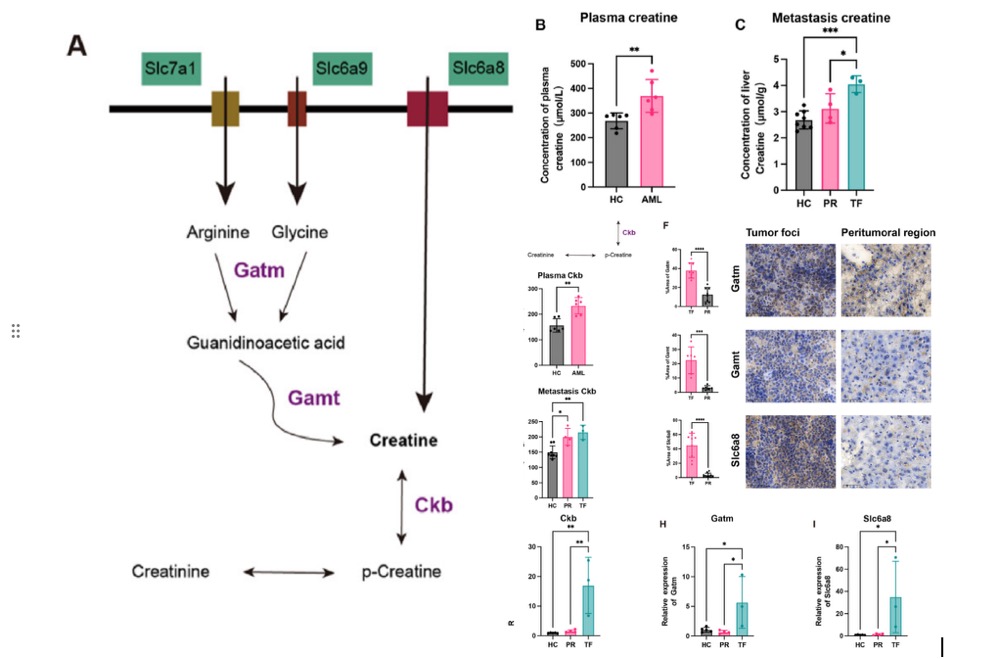
图4 通过生物合成与转运机制增强AML小鼠肝转移中肌酸代谢通路。(A)AML细胞通过两种途径积累肌酸:一是通过Gatm和Gamt酶从精氨酸和甘氨酸合成,二是经肌酸转运体Slc6a8转运。(B,C)采用ELISA法检测AML小鼠与健康小鼠血浆(B)及肝转移灶(C)中的肌酸浓度。(D,E)通过ELISA法测定AML小鼠与健康小鼠血浆(D)及肝转移灶(E)中的肌酸激酶B(Ckb)水平。(F)免疫组化分析比较肿瘤病灶与周围区域的Gatm、Gamt和Slc6a8表达差异。(G-I)采用qRT-PCR检测AML小鼠肝转移灶与健康小鼠中Ckb (G)、Gatm (H)及Slc6a8 (I)的相对mRNA表达量。
本研究通过体外实验证实,多种AML细胞系(M4亚型C1498、MV4-11及M5亚型MOLM-13、THP-1)的增殖具有肌酸依赖性:添加5 mmol/L肌酸可促进细胞增殖(如C1498在12小时、MOLM-13在48小时增殖率上升),而Slc6a8转运蛋白抑制剂ompenaclid(10 mmol/L)通过阻断肌酸摄取降低细胞内磷酸肌酸/ATP水平,显著抑制增殖(如THP-1在24小时持续抑制,C1498在48小时明显下降),且不同亚型细胞响应时间存在差异(图6A-D)。在AML小鼠模型(C1498-Luc/GFP)中,补充肌酸显著增加肝转移灶(IVIS成像,图6E/F),而ompenaclid治疗组转移灶轻微减少且无毒性副作用(体重、体温、血液指标正常),表明肌酸直接驱动肿瘤浸润。进一步的能量代谢分析揭示肌酸通过双重路径重编程代谢:在THP-1细胞中,肌酸增强氧化磷酸,具体表现为ATP生成量、最大呼吸速率、基础呼吸速率及备用呼吸能力的增强。同时肌酸通过代偿性糖酵解上调ECAR,而ompenaclid则抑制这些指标(图7A/C/E/G)。在C1498细胞中,肌酸特异性激活氧化磷酸化(图7B/D),而ompenaclid下调糖酵解(图7F/H)。这些结果系统阐明:肌酸-Slc6a8轴通过协同提升OXPHOS和糖酵解,驱动白血病细胞增殖、转移及代谢适应性。靶向该通路可有效抑制肿瘤进展,具有重要治疗潜力。
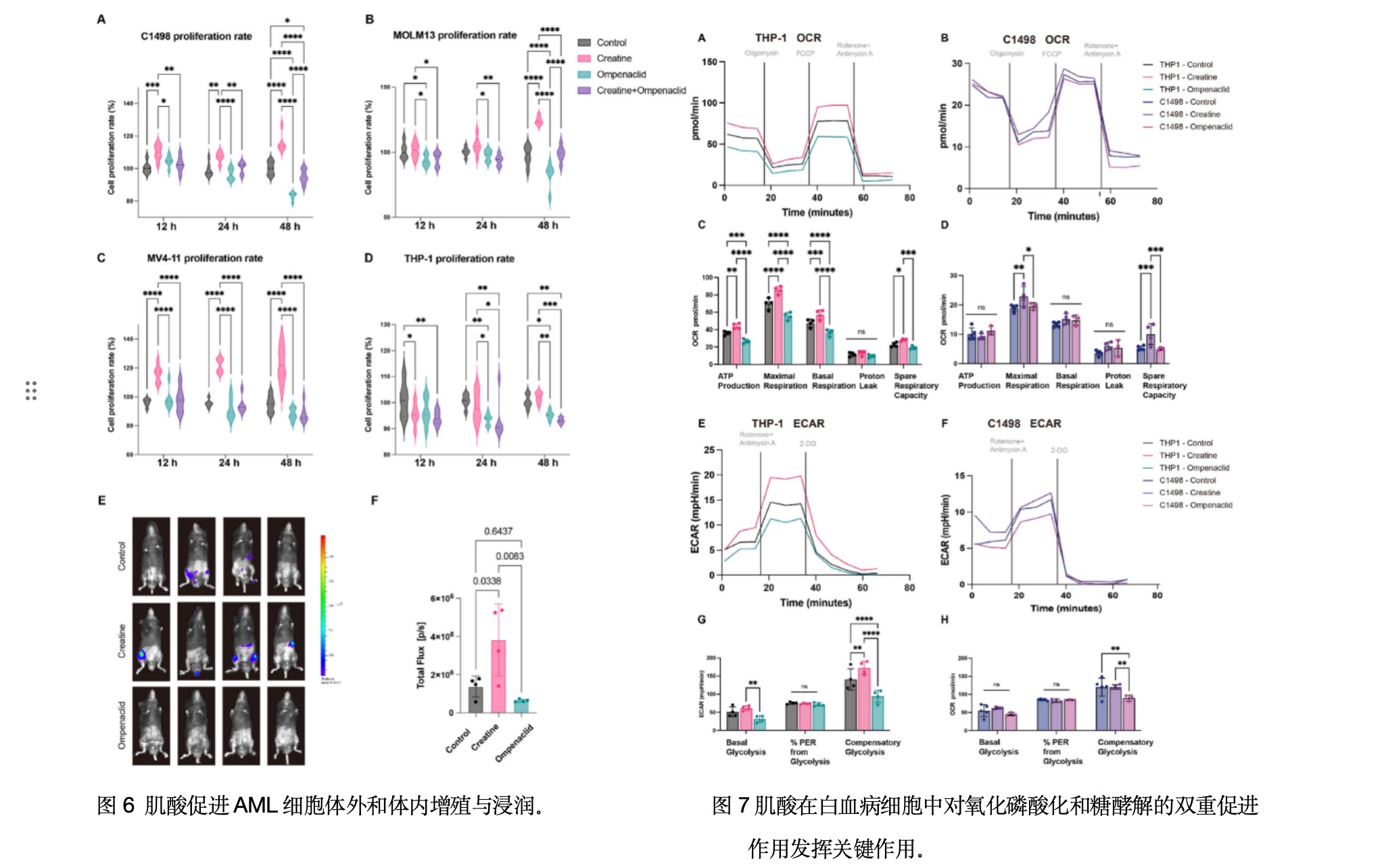
本研究研究揭示了急性髓系白血病(AML)小鼠肝转移灶中关键的代谢重编程机制,重点聚焦肌酸代谢通路。这些改变不仅支持转移性白血病细胞的增殖,更为创新治疗方案提供了新思路。通过抑制肌酸转运蛋白Slc6a8,可破坏白血病细胞的能量稳态,从而显著抑制其转移扩散。这一突破性发现为AML辅助治疗开辟了新方向,有望通过引入新型代谢通路实现精准干预。本研究不仅验证了AFADESI技术在肿瘤微环境研究中的高通量、空间分辨能力,也为AML代谢靶向策略提供了新思路。
中国农业科学院棉花研究所棉花生物育种与综合利用国家重点实验室李付广团队在《Nature Communications》上发表了一篇题为“Spatiotemporal transcriptome and metabolome landscapes of cotton somatic embryos”的研究文章。通过整合AFADESI空间代谢组学和单细胞RNA测序(scRNA-seq)、空间转录组学(ST)首次系统分析了棉花体细胞胚胎发生过程中关键基因的空间分布特征及代谢物的表达模式,并构建棉花体细胞胚胎发生过程基因数据库,为解决棉花体外再生技术难题提供了高效解决方案,助力深入解析植物发育分子机制的深度解析。(文章链接:https://doi.org/10.1038/s41467-025-55870-6)
棉花作为全球核心经济作物,其遗传改良受制于复杂耗时且基因型依赖的体细胞胚胎发生(SE)过程,然而当前棉花SE效率低下,核心瓶颈在于缺乏关于体细胞胚胎发生过程中基因表达模式重编程的精确细胞层面信息,而传统转录组技术(RNA-seq)因无法解析单细胞异质性及空间分辨率受限难以突破此困境;为此本研究采用多组学协同策略,通过单细胞RNA测序(scRNA-seq)绘制愈伤组织、球状胚、鱼雷胚和子叶胚四阶段转录图谱,同时采用AFADESI技术进行空间代谢组学研究,整合空间转录组(ST)与空间代谢组(SM)实现关键基因与代谢物的原位共定位,并基于跨组学关联构建基因-代谢物调控网络,揭示SE不同阶段的特异变化,为棉花遗传转化效率优化提供全新视角。
本研究采用多组学整合策略解析棉花体细胞胚胎发育机制,选取非胚性愈伤组织(NEC)、胚性愈伤组织(EC)、球形胚(GE)、鱼雷胚(TE)和子叶胚(CE)五个关键发育阶段样本。样本经OCT包埋冷冻切片,采用AFADESI-MSI技术进行空间代谢组(SM)分析,基于10x GenomicsVisium平台,通过组织透化、mRNA捕获及Illumina测序实现空间基因表达谱解析,完成空间转录组(ST)分析。同时,制备酶解原生质体悬液,使用10xChromium单细胞3’试剂盒进行单细胞转录组(scRNA-seq)文库构建和测序。验证体系包含利用CRISPR/Cas9技术对关键基因(AATP1、DOX2)进行敲除或过表达、采用LC-MS/MS靶向定量关键代谢物以及应用原位杂交(ISH)技术空间定位基因表达。数据分析方面,scRNA-seq数据使用Seurat包进行UMAP降维聚类与差异表达基因筛选,SM数据基于OPLS-DA模型鉴定差异代谢物,并整合ST、scRNA-seq和SM数据构建基因-代谢物关联网络。最终,所有整合数据存储于支持多维查询与分析的交互式数据库(https://cotton.cricas.com.cn/somaticembryo/)。
本研究基于空间转录组(ST)技术,系统解析了棉花体细胞胚胎发育过程中基因的空间表达模式(图1a-c)。研究选取球状胚、鱼雷胚和子叶胚三种胚胎组织进行切片处理,并通过空间位点识别技术,成功鉴定出801~1217个高质量位点。平均每个位点检测6287~8001个表达基因。进一步,利用均匀流形近似与投影(UMAP)方法,将检测到的基因划分为13个细胞簇,并将其映射回原始组织切片位置(图1d-e)。此外,研究还绘制了各细胞簇中高表达基因的点图(图1f);图中显示的簇特异性高表达基因,提示其可能参与调控特定细胞簇的发育功能。最后,研究人员在13个细胞簇中鉴定了差异表达基因(DEGs),并进行了GO富集分析。结果显示,与“胚胎后发育调控”相关的基因在子叶细胞(簇9)中显著富集,而与“生物胁迫防御响应”相关的基因则主要在皮质细胞(簇 11)中高表达。这些发现表明,差异表达基因可能在体细胞胚胎发生(SE)的不同阶段发挥着特定的生理功能力。
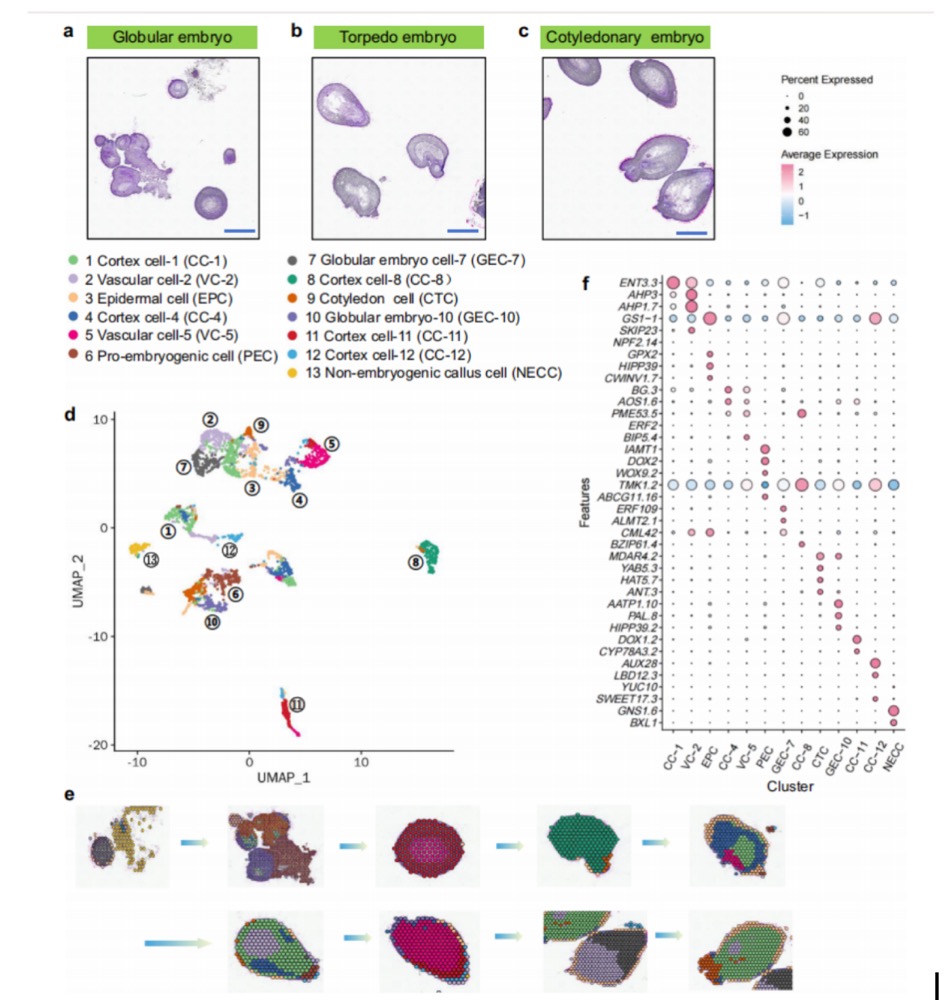
图1 棉花体细胞胚胎发生三个阶段的空间分析。a-c为棉球形胚、鱼雷胚和子叶胚经苏木精-伊红(H&E)染色的切片。d UMAP可视化显示体细胞胚胎细胞,每个数字代表不同细胞类型,各色标记对应不同细胞类型。e图(d)中的所有聚类均被映射到其空间位置,其中13个聚类分别位于不同的组织区域。f点图展示了各细胞聚类中代表性标志基因的表达情况。
研究人员利用ST分析了棉花下胚轴诱导产生的愈伤组织,得到了六个细胞簇(图2a)。通过对愈伤组织中细胞簇的分析,发现与维管组织标记基因 aintegumenta(ANT)同源的基因(Gh_A11G229400)和与干细胞形成相关基因 wuschel-related homeobox13(WOX13)同源的基因(Gh_A02G209400)在簇1中表达,表明簇1包含来自外植体的维管组织细胞和愈伤组织创始细胞。同样,通过与已鉴定的愈伤组织细胞类型的比较,确定簇1为“外植体维管组织和愈伤组织创始细胞_1”。此外,还对其他细胞簇中的标记基因进行了分析和鉴定,并对差异表达基因(DEGs)进行了GO分析,发现“外植体维管组织和愈伤组织创始细胞_3”和“愈伤组织细胞内层_5”(簇3和5)中的大多数DEGs主要参与对缺氧的响应和防御反应。
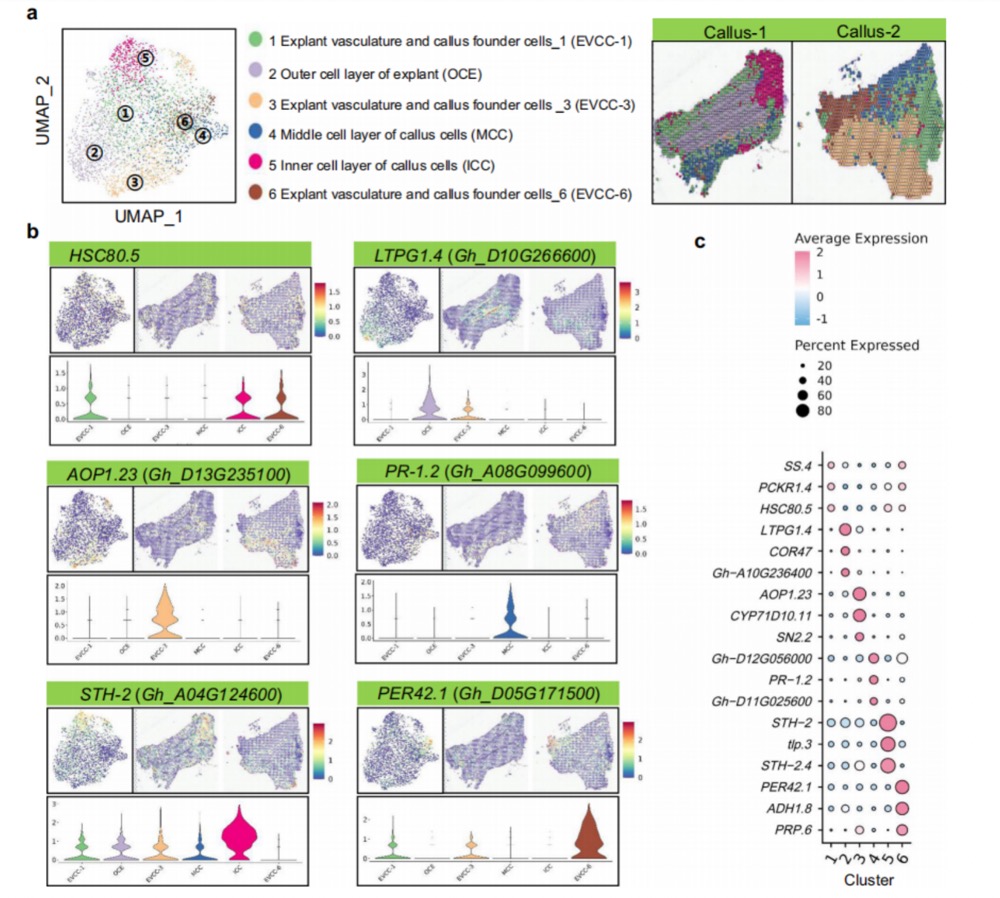
图2 非胚胎性愈伤组织的空间分析。aUMAP可视化愈伤细胞分布图。b HSC80.5、LTPG1.4、AOP1.23、PR-1.2、STH-2和PER42.1标记基因在callus_1和callus_2中的空间表达位置图。c细胞簇中标记基因表达的散点图,圆点大小代表该基因在细胞簇中的表达比例。
为解析棉花体细胞胚胎发育过程中基因表达与组织分化的关联机制,研究者对球状胚、鱼雷胚及子叶胚三类样本进行了九组空间切片分析,通过Pearson相关性评估揭示了发育阶段间的遗传调控网络特征。在空间维度上对不同细胞簇差异表达基因(DEG)进行功能注释发现:空间定位1号区域中,维管组织标记基因WOX13的同源转录本在非胚胎形成愈伤细胞簇(簇1)呈现显著激活;而早期胚胎维管关键因子ATHB-8(Gh_D05G049400)与多能性获得核心调控基因BBM(Gh_D08G251600)的同源序列在球状胚细胞簇(簇1)中同步高表达。空间定位2号区域分析表明,表皮发育调控因子PDF1(Gh_D04G040400)及其胚胎命运决定基因WOX9的同源序列在胚胎前体细胞群中均表现出特异性转录激活。这些空间表达模式印证了特定细胞簇通过差异基因表达驱动胚胎发育阶段特化的生理功能分化。(图示见补充图3-11)
通过单细胞转录组测序技术对棉花体细胞胚胎发育过程进行解析,研究人员在球形胚、鱼雷胚和子叶胚阶段分别获得8842、9031和9037个高质量单细胞,平均检测基因数达1992-2339个。UMAP降维分析将细胞划分为11个功能簇,其中簇2通过MPK3同源基因Gh_A05G087300的高表达被鉴定为表皮细胞亚群,该基因在拟南芥中已知参与表皮分化与胚胎发育调控。空间转录组与单细胞数据的强相关性验证了分析可靠性,如簇3中生长素响应基因AUX22和簇5中叶肉特征基因CYP87A3的共定位表达,揭示了不同细胞类型在胚胎发育中的功能特化。这种多组学整合策略为解析棉花体细胞胚发育的分子机制提供了单细胞分辨率的关键证据。
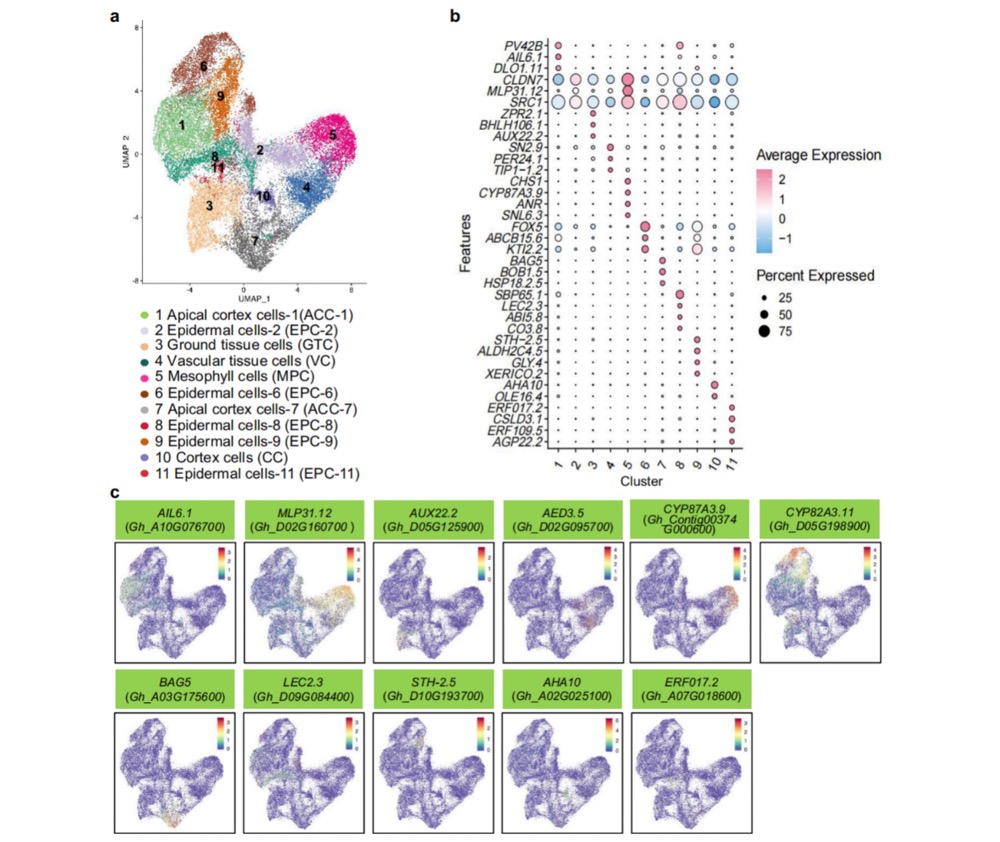
图3 棉花体细胞胚发育的单细胞分析,a球状胚、鱼尾胚和子叶胚中单细胞的减少与聚类分析。b点图展示了代表性标记物的表达情况。每个细胞簇中的基因。c不同细胞簇中代表性标记基因的表达情况。
为解析棉花体细胞胚胎发育的细胞分化路径,研究团队采用拟时序分析技术重构了不同类型细胞的发育轨迹(图4a)。结果显示,不同细胞簇在拟时序轨迹的分支节点呈现明确的空间分离特征(图4b),且在发育时间轴上表现出三类显著的基因表达模式(图4c)。值得注意的是,受精当天特异性激活的33个标志基因被成功鉴定,包括木葡聚糖内转糖基化酶及乙烯合成关键酶ACC合酶等调控因子(图4)。进一步的基因功能分析揭示:相较于受精前一日,受精当日上调的差异表达蛋白在蛋白质翻译过程(GO:0006412)及核糖体小亚基组装(GO:0000028)等生物学功能中显著富集。同时,研究还挖掘出参与纤维细胞早期发育的核心基因群,如调控鞘脂代谢的GhKSR1(通过影响超长链脂肪酸合成促进纤维伸长),以及昼夜节律调控因子GhTCP14(通过协调线粒体代谢与蛋白翻译活动驱动纤维生长)。这些发现为解析棉花胚胎发育与纤维形成的分子网络提供了关键靶点。
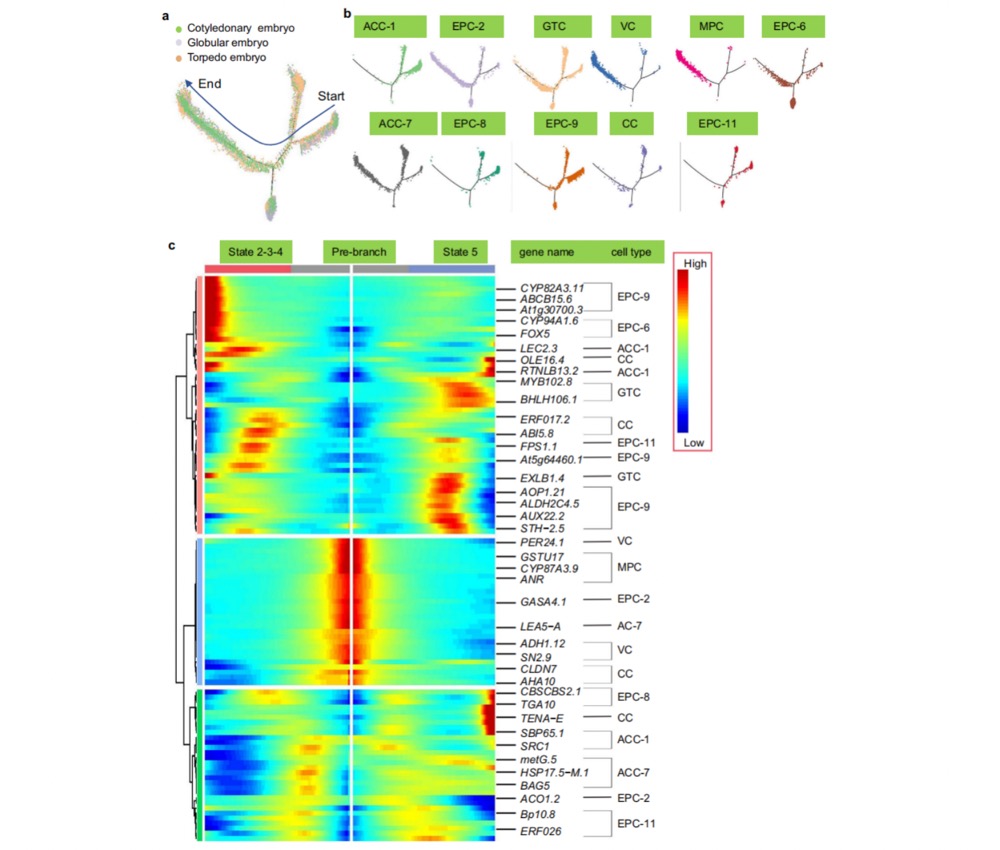
图4 对受精前1.5天到受精后1天的所有棉花胚珠样品进行拟时序分析。a细胞簇在胚胎发育三个阶段的分布情况,基 于伪时间轨迹呈现。b假时间轨迹按细胞簇颜色进行区分标记基因在伪时间上的表达动态与聚类分析。
胚胎发生的初始阶段在非胚性愈伤组织细胞向胚性细胞转化过程中发挥决定性作用,ST数据揭示了多个高度表达基因与特定细胞簇相关联,包括“非胚性愈伤组织”(第13组)、“前胚性细胞”(第6组)和“球形胚胎cell_10”(第10组),这些基因簇为细胞命运转换提供了分子基础。原位杂交(ISH)分析显示,ABC转运蛋白G家族成员11(ABCG11)在球形和鱼雷胚胎的内皮层中呈现优势表达(图5b-d),该基因在拟南芥中编码表皮脂质转运蛋白,表明其在植物胚胎脂质运输和保护屏障形成中的保守功能。胚胎表皮的建立与维持对胚胎正常发育至关重要,在高等植物中,芽器官的表皮直接源于胚胎表皮,提供抵御生物和非生物胁迫的保护机制,确保了发育过程中的结构完整性。基于ST数据集,研究聚焦于“表皮细胞”(簇3)、“皮质细胞_1”(簇3)和“皮质细胞_12”(簇3)中表达的关键调控基因,以解析皮质层和表皮细胞发育的分子调控网络。富含半胱氨酸的受体样蛋白激酶29(CRK29)作为受体样激酶家族成员,在棉花“表皮细胞”及早期球形与鱼雷胚胎表皮中均表现出显著表达,突出了其在表皮特异化中的潜在作用。ISH结果进一步证实,Gh_A13G249900(AHP3同源基因)在球形胚胎皮层中表达,并在鱼雷和子叶胚胎皮层中广泛分布,同时LBD12主要在鱼雷胚胎皮层富集,这些结果一致性地验证了细胞簇分类的准确性和可靠性。
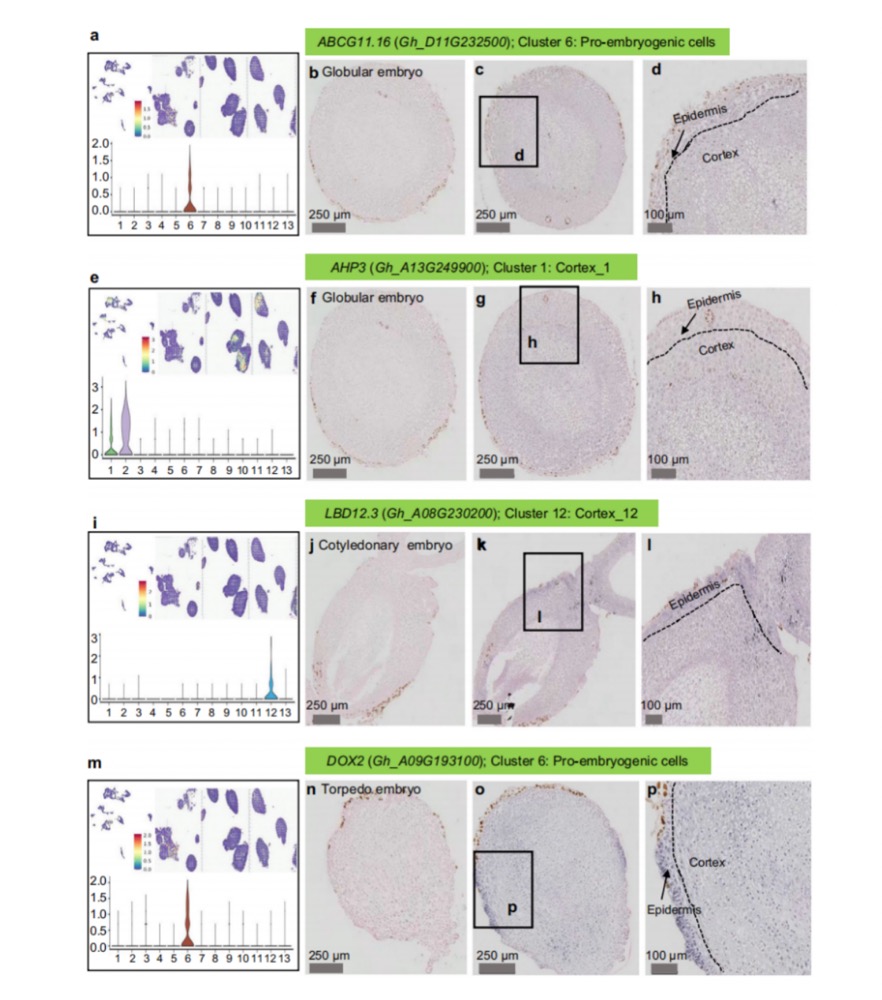 图5 棉花中调节SE的特定基因的时空分析。a、e、i、m不同基因簇中ABCG11.16(Gh_D11G232500)、AHP3(Gh_A13G249900)、LBD12.3(Gh_A08G230200)和DOX2(Gh_A09G193100)标记基因表达的空间定位图及小提琴图谱。b、f、j、n为阴性原位杂交对照组.c、g、k、o为棉花体细胞胚胎中标记基因的ISH定位结果。d、h、l、p为所标示矩形切片的放大视图。
图5 棉花中调节SE的特定基因的时空分析。a、e、i、m不同基因簇中ABCG11.16(Gh_D11G232500)、AHP3(Gh_A13G249900)、LBD12.3(Gh_A08G230200)和DOX2(Gh_A09G193100)标记基因表达的空间定位图及小提琴图谱。b、f、j、n为阴性原位杂交对照组.c、g、k、o为棉花体细胞胚胎中标记基因的ISH定位结果。d、h、l、p为所标示矩形切片的放大视图。
研究人员通过空间转录组(ST)分析发现AAA-ATPase1(AATP1)在"球状胚_10"(簇10)中特异性表达,DOX2在"前胚性细胞"(簇6)中显著富集。为验证其功能,构建了三个过表达(OE)系和三个CRISPR/Cas基因编辑系。结果显示,OE系中AATP1和DOX2表达水平显著增加,而CRISPR编辑系实现靶向敲低。表型分析发现,AATP1-CAS和DOX2-CAS愈伤组织在诱导30天后体积大于野生型(WT),增殖速率更快;90天后呈现易碎胚性特征,分化率显著提升,细胞呈原始圆形或椭圆形。相反,AATP1-OE和DOX2-OE愈伤组织增殖缓慢,体积显著小于对照组,90天后硬化且无胚胎发生迹象,细胞伸长显示非胚性状态。这些结果表明AATP1和DOX2通过负向调控愈伤组织增殖与胚性细胞转化,影响体细胞胚胎发生进程。AAA-ATP酶作为能量依赖的分子马达,可能通过改变蛋白复合物构象参与细胞命运决定。
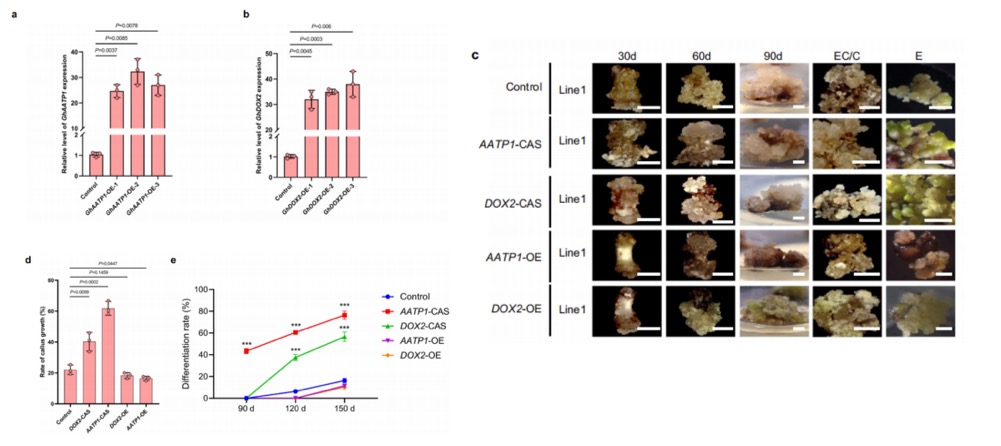 图6 棉花愈伤组织发育的代表性标记基因的功能分析。a、b通过qRT-PCR检测OE品系与对照材料中GhAATP1 (a)和GhDOX2(b)的相对基因表达量,以GhHIS作为内参基因。c AATP1-CAS、DOX2-CAS、对照组、AATP1过表达组和DOX2过表达组材料在初始愈伤组织诱导30天、60天及90天后,以及胚胎形成阶段(EC/C)和胚胎期(E)的发育模式。比例尺=5毫米。d不同材料在初次诱导愈伤组织后30天的愈伤组织生长速率。
图6 棉花愈伤组织发育的代表性标记基因的功能分析。a、b通过qRT-PCR检测OE品系与对照材料中GhAATP1 (a)和GhDOX2(b)的相对基因表达量,以GhHIS作为内参基因。c AATP1-CAS、DOX2-CAS、对照组、AATP1过表达组和DOX2过表达组材料在初始愈伤组织诱导30天、60天及90天后,以及胚胎形成阶段(EC/C)和胚胎期(E)的发育模式。比例尺=5毫米。d不同材料在初次诱导愈伤组织后30天的愈伤组织生长速率。
本研究整合OPLS-DA代谢谱型分析与AFADESI-MSI技术,系统揭示了棉花体细胞胚胎发育过程中74种差异代谢物(DPMs)在26条代谢通路内呈现组织特异性分布。子叶区域特异性富集L-精氨酸(C00062)、N-氨基甲酰腐胺(C00436)及吲哚-3-乙醛(C00637),驱动精氨酸-脯氨酸代谢通路主导胚胎器官建成。皮层区域显著富集亚油酸(C00062)、(S)-β-氨基异丁酸(C03284)及D-苹果酸(C00497),共同调控脂质代谢与微环境应激响应。维管组织特异性积累亚精胺(C00315)与异丁香酚(C10469),支撑多胺生物合成过程。跨组织代谢网络分析进一步显示,子叶区域的二氢玉米素(C02029)激活了玉米素/嘌呤代谢通路。该通路与皮层区域富集的L-天冬氨酸(C00049)、L-组氨酸(C00135)协同作用,共同调控组氨酸代谢通路。这些相互作用共同协调了棉花胚胎的器官发生程序。所有空间代谢图谱结果均通过液相色谱-串联质谱(LC-MS/MS)进行了平行验证,确证了AFADESI-MSI技术在亚器官分辨率下,对包括脂质、TCA循环、氨基酸、核苷酸等在内的8大类代谢通路具有广泛的覆盖能力和可靠的定量性能。
整合空间代谢组(SM)与空间转录组(ST)数据联合分析,研究发现多胺合成关键基因(SPDSYN1, SPMS)在球状胚特异性高表达,其表达峰值与胚内精胺/亚精胺蓄积显著正相关,标志二者为球状胚发育特征代谢物。子叶胚中茉莉酸合成基因OPR11显著激活,指示茉莉酸为子叶胚发育动态因子。KEGG通路解析表明,DOX2通过α-双加氧酶活性催化α-亚麻酸(C06427)生成2(R)-HPOT,结合SM显示鱼雷胚期α-亚麻酸含量骤降,共同证实DOX2负调控α-亚麻酸合成以保障正常发育。跨平台数据一致验证多胺-茉莉酸代谢轴的阶段特异性切换对棉花胚胎形态建成具决定性作用。
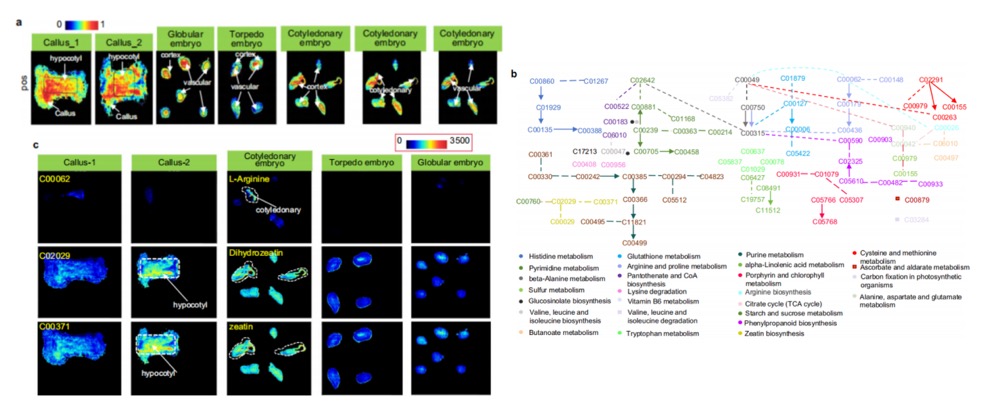
图7 发育中棉花体细胞胚胎代谢物的空间分布分析.a选取正离子扫描模式下的部分代谢特征指数(MSIs),用于标记不同发育阶段样本的组织区域。这些代谢特征指数并不代表特定代谢物。b棉花体细胞胚胎代谢网络。该代谢网络基于与不同发育阶段相关的动态代谢模块(DPMs)构建而成。胚胎发育。数字代表KEGG注释,颜色对应相关代谢通路。实线表示单步反应, 虚线表示两步或更多步骤的反应。c 体细胞胚胎中L-精氨酸、二氢玉米素和玉米素的MSI。
本研究基于多时期采样策略,结合空间转录组学、空间代谢组学和单细胞转录组学技术,系体阐明了棉花体细胞胚胎发育全周期中特定组织和细胞类型相关的转录组及代谢变化。研究鉴定了AATP1和DOX2等关键调控因子,并构建了可搜索的网络资源数据库(https://cotton.cricaas.com.cn/somaticembryo/),为棉花遗传转化和育种提供了重要参考。功能分析表明AATP1和DOX2在棉花体细胞胚胎发生过程中具有负调控作用,为深入理解棉花体细胞胚胎发生的分子机制提供了新视角。研究揭示了α-亚麻酸作为纤维伸长标志性代谢物的关键作用,同时发现α-酮戊二酸、L-天冬氨酸、脂肪酸代谢物、胺类物质、生长素及油菜素内酯类似物等多种代谢物在棉花纤维早期发育中的重要作用。
电话: 010-57562186
地址: 北京市通州区张家湾镇方和正圆工业园区1号楼7124室
网站所展示产品资料及技术参数等数据仅供参考,不作为销售约束性的条件。
具体以实际产品说明书为准。




