Spatial isotope deep tracing deciphers inter tissue metabolic crosstalk
Xinzhu Li, Ying Zhu, Ting Li , Xinyi Tu, Shiyu Zhu, Lingzhi Wang, Fei Li, Chenglong Sun, Xin Li , Haiyi Zhao, Tang Tang, Qingce Zang , Ruiping Zhang & Zeper Abliz

发布期刊:Nature Communications
影响因子:15.7
DOI:10.1038/s41467-025-63243-2
研究背景:在哺乳动物体内,器官间协同运作维持代谢稳态,研究组织间代谢互作对揭示发育机制及发现新的治疗靶点具有重要意义。基于质谱成像(MSI)的空间代谢组学技术能够原位解析上千种分子的空间分布,广泛应用于揭示代谢异质性。然而,MSI技术仅能提供代谢物的相对含量信息,无法直接反映代谢通路的活性。与此同时,稳定同位素示踪法可以反映代谢通路活性却无法揭示器官内代谢异质性。基于此,本研究开发了MSITracer智能计算分析工具,结合稳定同位素示踪技术与实验室自主研发的高灵敏度空气动力辅助离子化质谱成像技术(AFADESI-MSI)实现组织内代谢网络的空间动态追踪,为解析营养物质代谢命运及组织间代谢通讯机制提供了新的技术方法。
技术方法:
同位素标记法、空间代谢组学、空气动力辅助离子化质谱成像技术(AFADESI-MSI)、液相色谱-串联质谱(LC-MS/MS)、蛋白质定量技术、免疫组化
研究亮点:
1. 将高灵敏高通量AFADESI-MSI技术与同位素示踪相结合,突破MSI技术无法反映代谢通路活性的局限,实现了组织间代谢互作的空间追踪。
2. 自主研发MSITracer智能分析工具,实现从复杂MSI数据中全面解析标记代谢物,同时自动计算空间同位素示踪标记组分比例,构建了哺乳动物体内标记代谢物的最大规模数据库(基于U-¹³C葡萄糖和U-¹³C谷氨酰胺的体内输注研究),有效补充并大幅拓展了传统代谢组学研究积累的知识体系。
研究思路
本研究建立了一套基于活体¹³C同位素示踪与高灵敏AFADESI-MSI技术的空间代谢流分析体系。研究通过静脉注射U-¹³C葡萄糖和U-¹³C谷氨酰胺示踪剂,系统分析小鼠整体样本和九个主要器官(脑、肝、肾、心、脾、肺、胰、肌肉及棕色脂肪组织)的冷冻切片,以及血清和主要器官组织匀浆样本。采用LC-MS实现标记代谢物的识别与同位素分布定量;AFADESI-MSI则获取代谢物在组织微区及整体小鼠的原位空间分布。通过自主开发的MSITracer计算平台,完成同位素离子的自动匹配、天然丰度校正及标记分数计算,实现精准的空间同位素追踪。该方法为活体组织代谢活动的系统性原位表征及组织间代谢通讯的解析提供了新途径。
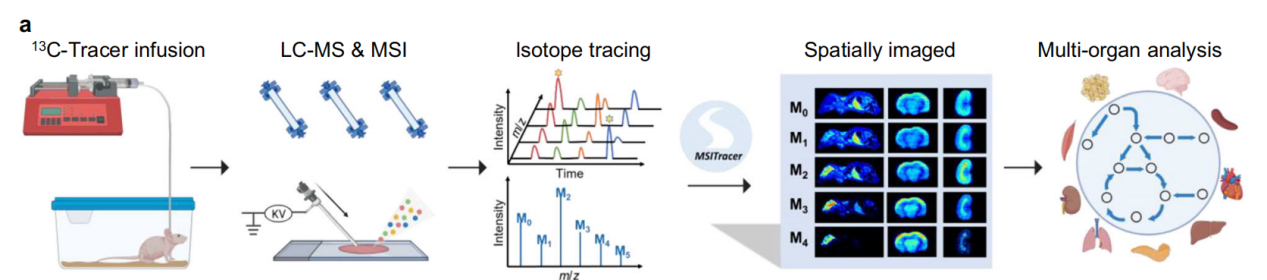
图1 空间同位素深度追踪技术框架
研究结果
1、稳定同位素深度示踪技术全面绘制活体标记代谢物分布图谱
研究通过连续静脉注入U-¹³C葡萄糖和U-¹³C谷氨酰胺示踪剂两种稳定同位素底物,对小鼠体内多器官代谢流进行系统追踪。LC-MS/MS分析结果显示:在U-¹³C葡萄糖输注后鉴定到1274种标记代谢物(3227个同位素异构体),U-¹³C谷氨酰胺输注后鉴定到462种标记代谢物(1018个异构体),覆盖36条代谢通路,器官特异性分析表明,肝脏含有最丰富的标记代谢物,确认其代谢枢纽地位;大脑对葡萄糖标记响应最强,胰腺则对谷氨酰胺标记最为敏感。特别值得注意的是,约四分之三的标记代谢物仅存在于单一组织中,揭示了显著的器官代谢异质性。研究还意外发现三种未知代谢物的标记率高于经典糖酵解中间产物,为后续研究提供了新的方向。
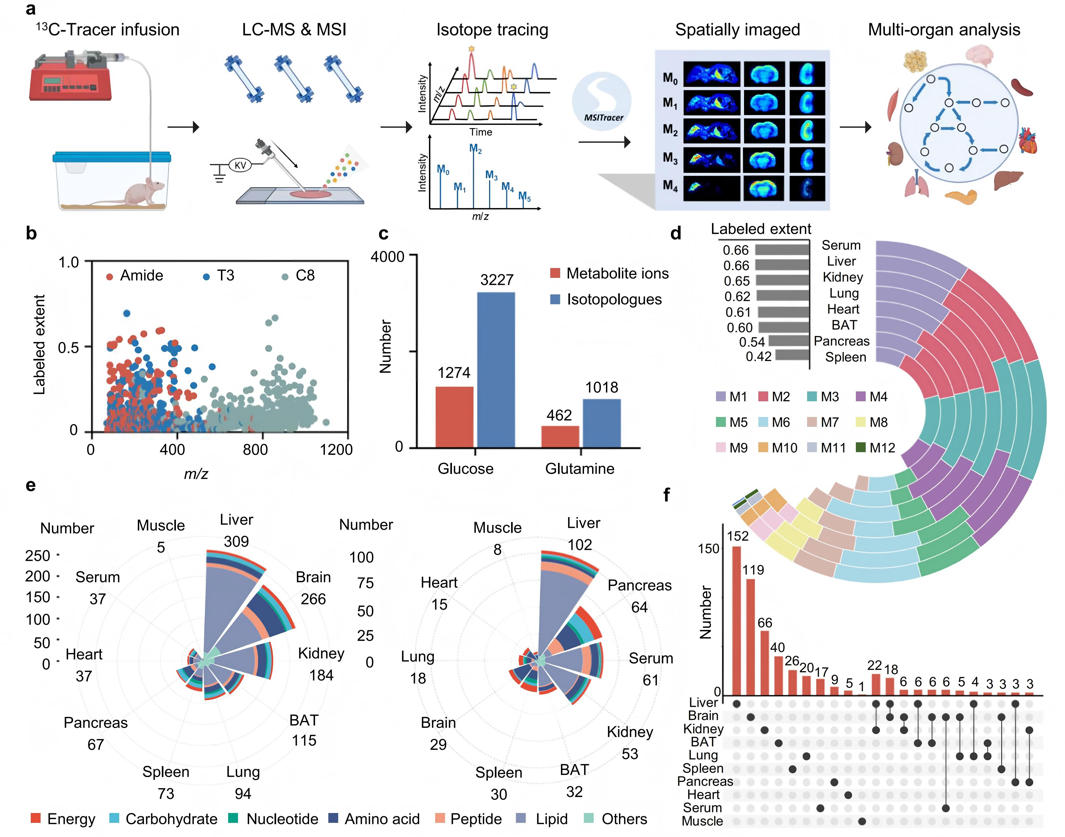
图2 体内同位素深度追踪
2、空间同位素追踪工具:MSItracer的开发与验证
本研究基于LC-MS/MS鉴定的标记代谢物数据,开发了专用于空间同位素追踪的分析工具MSITracer。该工具通过构建包含U-¹³C葡萄糖(2,394种代谢离子,65,303个同位素异构体)和U-¹³C谷氨酰胺(928种代谢离子,27,458个同位素异构体)的MSI专属数据库,解决了LC-MS与MSI系统间加合离子差异的技术难题。MSITracer通过三重核心步骤实现精准分析:自动匹配同位素异构体、筛选有效成像信号、量化标记模式与组分比例。验证实验表明,该工具在肾脏连续切片的对比分析中,对三羧酸循环、糖酵解等关键代谢途径的五种代表性代谢物均显示出与LC-MS一致的标记模式,证实其定量准确性。
采用AFADESI-MSI技术对小鼠整体和器官切片进行成像分析,结果显示, U-¹³C葡萄糖标记的谷氨酸主要分布于大脑;U-¹³C谷氨酰胺标记的谷氨酸则主要集中在胰腺。此外,在肾脏等异质性组织中,谷氨酸同位素异构体M2的标记比例在髓质(Me)最高,而同位素异构体M5在内皮层(Ic)的标记强度最强。类似区域特异性的营养利用差异也在大脑中被检测到。
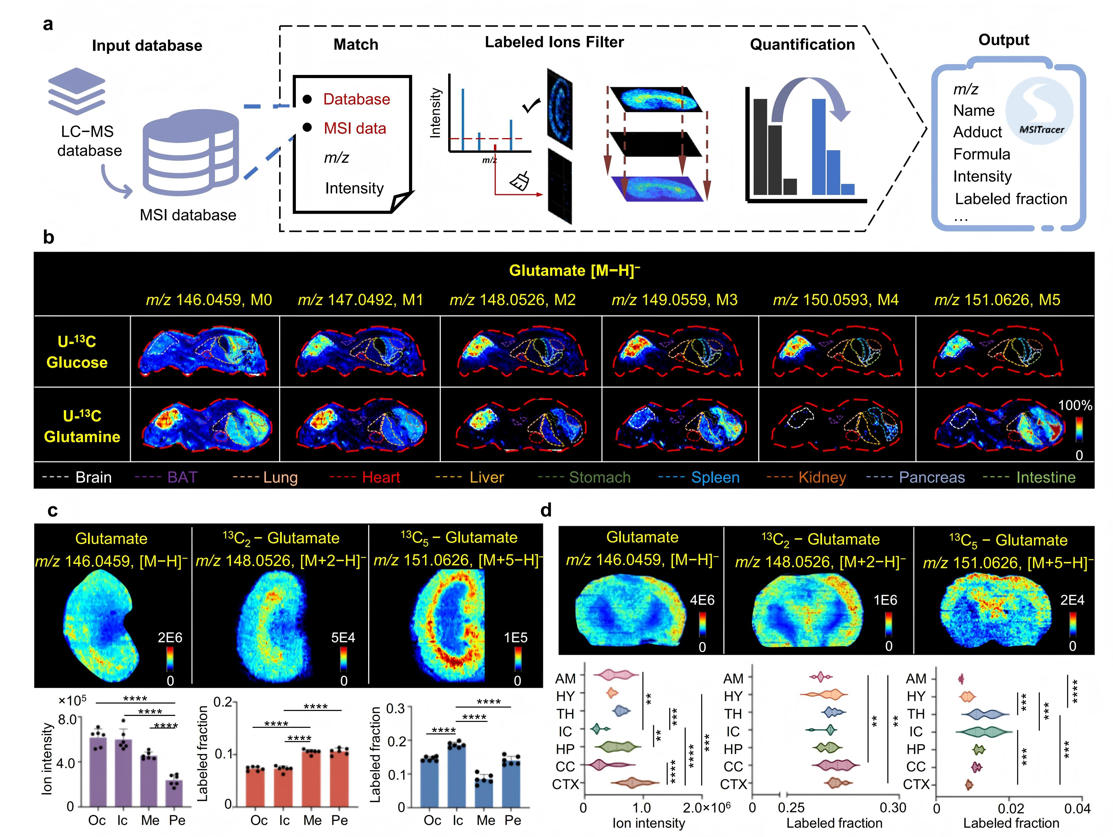
图3 MSITracer实现从全身动物到组织微区的同位素空间追踪
3、器官特异性代谢活性的表征
研究通过MSITracer平台揭示了多器官代谢网络的空间特征。U-¹³C葡萄糖示踪显示肺部对葡萄糖摄取最活跃,肾脏糖异生活性最强;U-¹³C谷氨酰胺实验则证实胰腺对其利用最为显著。脑组织表现出高度活跃的三羧酸循环,其M4代谢物显著富集,且动态代谢流分析显示其中间产物周转速率最快。
研究首次发现肾-肝-脑代谢轴:在谷氨酰胺输注后,大脑中谷氨酸M2/M1来源于肾肝糖异生途径,该机制通过相应器官中糖异生酶表达上调得到验证。空间分辨代谢追踪技术不仅支持跨组织代谢活动的定量比较,同时也为揭示器官间代谢通讯机制提供了重要线索。
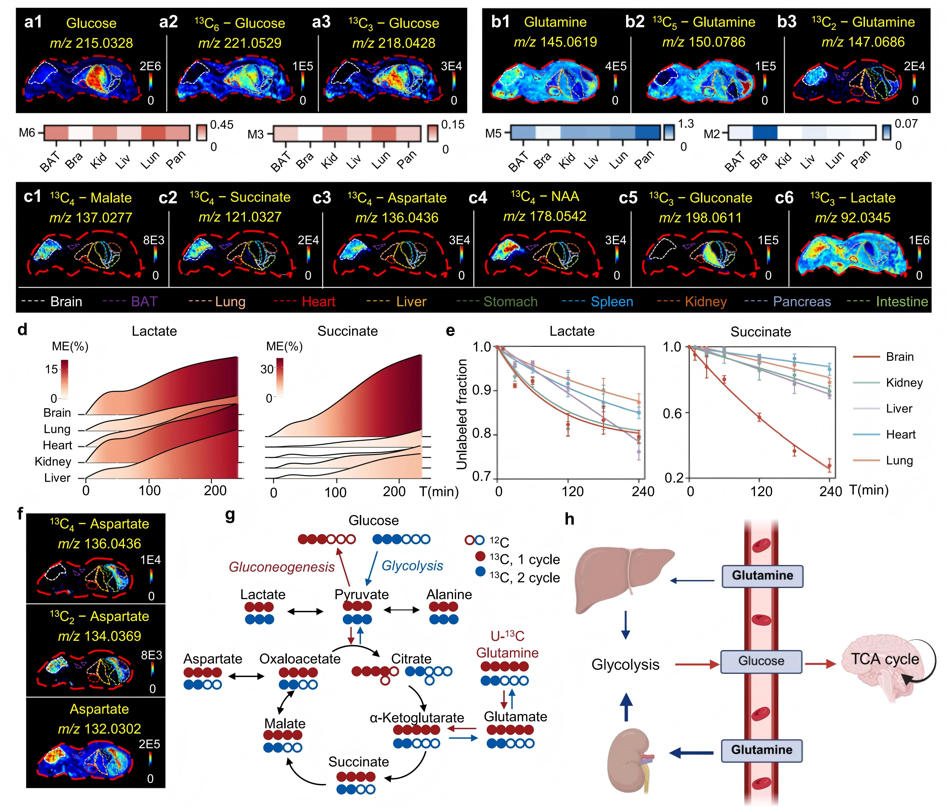
图4 使用MSITracer进行器官特异性代谢活性表征
4、破译器官间的代谢通讯
研究通过AFADESI-MSI结合同位素示踪法分析代谢物M0与Mn的空间分布差异(n为代谢物中碳原子总数)。研究发现棕色脂肪组织(BAT)是脂肪酸从头合成的主要场所,其产生的标记脂肪酸(如棕榈酸M1-M6)与大脑中存在的天然脂肪酸(M0)形成鲜明对比。心脏则表现出最强的脂肪酸氧化活性,乙酰肉碱M2在此处标记水平最高。机制研究表明,BAT和大脑利用葡萄糖合成脂肪酸,而肝脏主要通过标记的甘油骨架合成甘油三酯。不同器官的甘油三酯标记模式各异:BAT达M10,大脑至M7,而肝脏和血清仅M3。这种分布差异揭示了肝脏在脂质运输中的枢纽作用——将合成的脂质输送至心脏等器官供能,关键酶表达谱进一步验证了该代谢分工。这些发现共同勾勒出BAT-肝-心-脑多器官协同维持脂质稳态的代谢网络。
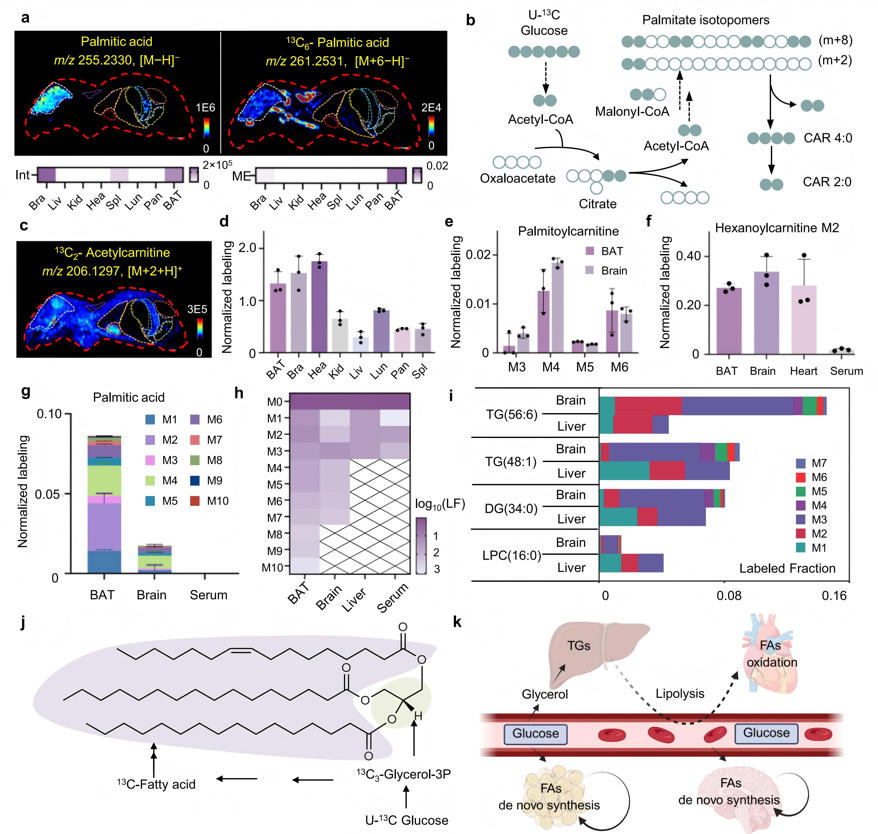
图5 解码器官间代谢通讯机制
5、荷瘤小鼠代谢协调的全身性丧失
代谢稳态失衡是癌症的标志性特征。然而,肿瘤对宿主代谢系统层面的影响尚未完全阐明。本研究通过向荷瘤小鼠体内输注U-¹³C葡萄糖,并采用液相色谱-质谱联用技术(LC-MS)与AFADESI-MSI技术,对小鼠全身代谢变化进行系统性分析,MSITracer技术可在5分钟内完成肿瘤内标记代谢物的注释。
研究发现肿瘤表现出独特的谷氨酸代谢异常。谷氨酸M2标记比例异常升高,超过其前体α-酮戊二酸,且与谷氨酰胺的相关性减弱,提示存在其他碳源补充。蛋白质组学分析显示肿瘤中谷氨酰胺酶(GLS)和谷氨酰胺转运蛋白(SLC1A5、SLC38A1)表达显著上调,而肝脏中谷氨酰胺合成酶(GS)表达下降。研究发现肺组织与血清中的谷氨酰胺同位素谱最为接近,表明肺部可能通过释放谷氨酰胺来满足肿瘤需求。
此外,肿瘤负荷导致宿主己糖胺生物合成途径严重受损,各器官中UDP-N-乙酰葡糖胺(UDP-GlcNAc)的标记完全消失,凸显了肿瘤对宿主全身代谢的深远影响。这些发现揭示了肿瘤通过改变局部代谢和引发全身性代谢失调,重塑宿主代谢稳态的新机制。
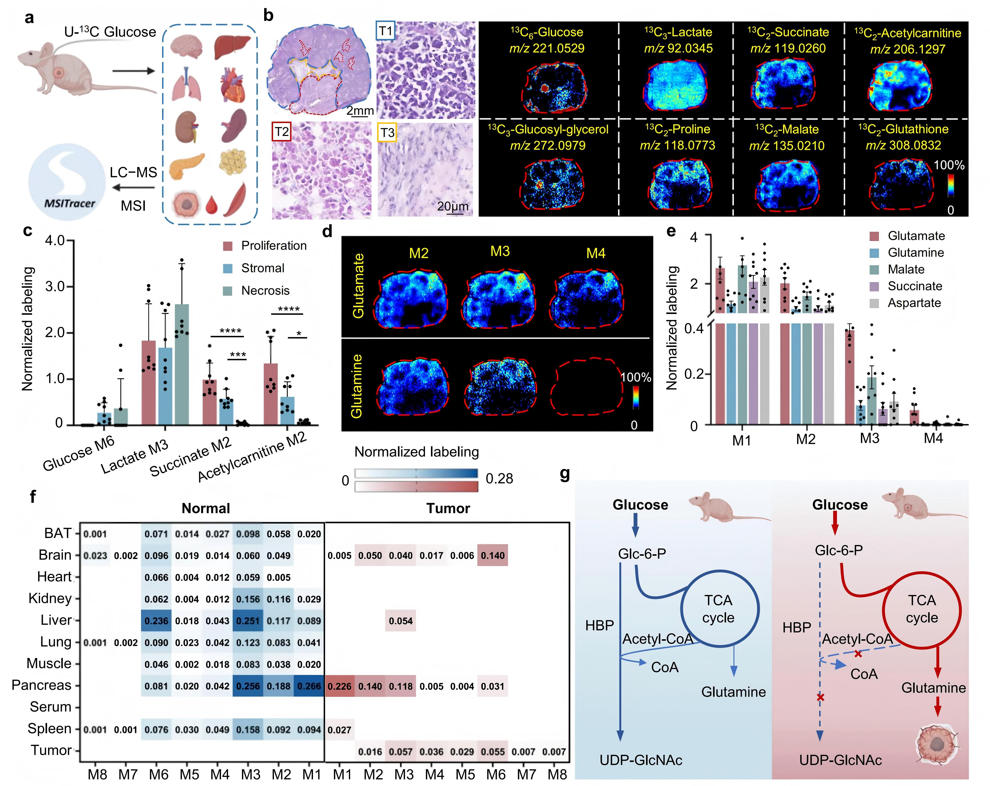
图6 异种移植小鼠模型中肝癌诱导的全身水平代谢改变
结论:
本研究结合AFADESI-MSI技术和同位素示踪技术建立了一套覆盖极性代谢物到脂质的标记代谢物追踪框架,突破了代谢组学研究难以同时获取代谢物空间分布信息与代谢通路活性的技术瓶颈。通过构建哺乳动物体内标记代谢物的最大规模数据库(基于U-¹³C葡萄糖和U-¹³C谷氨酰胺的体内输注)与MSITracer智能计算工具的开发,解决了标记代谢物全面识别的技术难题。最终,研究完整揭示了器官间的代谢分工、协作及肿瘤引发的全身代谢失调机制。但当前技术仍存在一些局限,包括空间分辨率和对同分异构体区分能力不足等。随着单细胞成像技术的发展以及其他技术的结合应用,这一工具将显著提升研究细胞相互作用、阐明组织微环境动态变化的能力。
文章链接:https://doi.org/10.1038/s41467-025-63243-2
电话: 010-57562186
地址: 北京市通州区张家湾镇方和正圆工业园区1号楼7124室
网站所展示产品资料及技术参数等数据仅供参考,不作为销售约束性的条件。
具体以实际产品说明书为准。





